«Проблемы экспертизы в медицине»,
2010, №3-4, с.32-35.
© С.С. Катаев, Е.А. Крылова, Н.Б. Зеленина, Л.Н. Курдина
УДК 340.67:543:615.214.24
С.С. Катаев, Е.А. Крылова, Н.Б.
Зеленина, Л.Н. Курдина
ИДЕНТИФИКАЦИЯ
МЕТИЛЕНДИОКСИПИРОВАЛЕРОНА И ЕГО МЕТАБОЛИТОВ В МОЧЕ МЕТОДОМ ГХ-МС
ГУЗОТ «Пермское краевое бюро судебно-медицинской
экспертизы»
(нач. бюро – В.Н. Коротун), г. Пермь
ГУЗ «Краевой наркологический
диспансер №1»
(гл. врач – С.Н. Еловиков), г. Пермь
В статье представлены
основные направления метаболической трансформации метилендиоксипировалерона
(МДПВ), соединения с психостимулирующей активностью. Проведена оценка наиболее
подходящих приемов для изолирования метаболитов МДПВ из мочи. При этом
установлено, что для этой цели предпочтительнее проведение ферментативного
гидролиза с последующей твердофазной экстракцией. Выполнена идентификация
основных метаболитов МДПВ в моче потребителей, полученные
газохроматографические и масс-спектрометрические характеристики некоторых
производных метаболитов МДПВ суммированы и представлены в виде сводных данных,
которые могут быть полезны в практике химико-токсикологического анализа.
Ключевые слова: метилендиоксипировалерон (МДПВ),
метаболизм, ферментативный гидролиз, твердофазная экстракция, газовая
хроматография – масс-спектрометрия.
IDENTIFICATION OF METHYLENEDIOXYPYROVALERONE AND
ITS METABOLITES IN URINE BY GC-MS
The basic pathways of the metabolic transformation of
methylenedioxypyrovalerone (MDPV), the psychoactive chemical substance, are
presented in this paper. The evaluation of the most applicable means for the
isolation of the metabolites of MDPV from urine is described. It appears that
performing of enzyme hydrolysis with following solid phase extraction is
preferential for this purpose. The identification of the main metabolites of
MDPV in urine of the users has performed and received gas chromatographic and
mass spectral characteristics of the some derivates of metabolites of MDPV are
summarized and shown as essential data which can be useful in chemical and
toxicological practice.
Key
words: methylenedioxypyrovalerone
(MDPV), metabolism, enzyme
hydrolysis, solid phase extraction, gas chromatography –
mass-spectrometry.
В последнее время широкое распространение в Пермском крае
получили различные психотропные синтетические субстанции, реализуемые под видом
удобрений, соли для ванн или ароматических отдушек. Одним из часто встречающихся соединений
является метилендиоксипировалерон (МДПВ), а так же его смеси с другими
психоактивными веществами и наполнителями.
МДПВ,
химическое название 1-(1,3-бензодиоксол-5-ил)-2-(1-пирролидинил)-1-пентанон (CAS № 687603-66-3), является психотропным веществом,
возбуждающим ЦНС, и действует как ингибитор обратного нейронального захвата
норадреналина и допамина. МДПВ не нашел широкого применения в медицине.
Во Франции и Германии в качестве
психостимулятора и аноректика
использовался пировалерон (аналог МДПВ), при чем описаны случаи
злоупотреблений и возникновения зависимости к данному препарату [3]. В России
пировалерон отнесен к психотропным
веществам и включен в Список III Переченя наркотических средств, психотропных
веществ и их прекурсоров, подлежащих контролю в Российской Федерации [1]. Сам
МДПВ в РФ не включен в перечни и списки контролируемых веществ, чем пользуются
недобросовестные предприимчивые субъекты. В то же время, например, в
Великобритании, благодаря деятельности Консультативного совета по
злоупотреблению наркотиками, МДПВ с 16 апреля
За первое полугодие
Таблица 1.
Случаи идентификации МДПВ в моче
потребителей за январь-июнь
|
Результаты исследования мочи |
«КНД №1» |
Токсикологичес- кое отделение МСЧ №9 |
Итого |
|
|
МДПВ |
5 |
6 |
11 |
|
|
комбинации с МДПВ |
+производные фенилалкиламина (амфетамин, метамфетамин, мефедрон,
бутилон) |
2 |
- |
2 |
|
+опиаты (морфин, кодеин) |
1 |
2 |
3 |
|
|
+М-холиноблокатор (тропикамид) |
- |
2 |
2 |
|
|
Всего: |
18 |
|||
В связи с широким
распространением злоупотреблений МДПВ, вследствие его относительно легкой
доступности (в том числе и на веб-сайтах), возникла необходимость его
определения в биологическом материале. Исходя из этого, нами проведены
предварительные исследования о возможностях идентификации МДПВ и его
метаболитов в моче потребителей с использованием методов экстракции: жидкость-жидкостной (ЖЖЭ)
или твердофазной (ТФЭ), - и газовой хроматографии с масс-спектрометрическим
детектором (ГХ-МС).
Оборудование
Газовый хроматограф Agilent 6850, оснащенный
капиллярной кварцевой колонкой НР-5MS длиной
Материалы и методы
Все используемые растворители и реактивы имели чистоту
х.ч. Патроны для ТФЭ AccuBond EVIDEX (200 мг/3 мл); β-глюкуронидаза,
Type HP-2, From Helix Pomatia, 101400 ЕД/мл, Sigma-ALDRICH Inc. Пробы мочи до исследования хранились при + 4оС.
Подготовка
проб мочи для хромато-масс-спектрометрического исследования.
Процедура скрининга
мочи. 2 мл мочи
помещали в стеклянный флакон объемом 10 мл, вносили по 50 мкл спиртовых
растворов внутренних стандартов: этилморфина гидрохлорида (0,02 мг/мл) и N-этилбензиламина (0,01 мг/мл),
добавляли 0,4 мл концентрированной хлористоводородной кислоты. Флакон плотно
укупоривали и выдерживали в термоблоке при 100оС в течение 15 мин.
Гидролизат охлаждали, прибавляли 0,8 мл
25% водного раствора аммиака. Контролировали рН (9-10 по
универсальной индикаторной бумаге) и дважды экстрагировали смесью
хлороформ – бутанол-1 (6:1) порциями по 2 мл. Органические
фазы отделяли, объединяли
и фильтровали через
бумажный фильтр с безводным
сульфатом натрия. Экстракт
выпаривали до сухого остатка в токе азота при 60оС.
Пробоподготовка мочи
для ТФЭ. К пробам
мочи объемом по 1 мл прибавляли по 50 мкл спиртовых растворов внутренних
стандартов: этилморфина гидрохлорида (0,02 мг/мл), N-этилбензиламина (0,01 мг/мл) и
гексенала (0,2 мг/мл). Далее проводили
предварительную подготовку образцов
одним из трех способов:
а) без гидролиза – к пробе мочи
прибавляли 2 мл 1/15М фосфатного буфера (pH6);
б) с применением кислотного гидролиза –
к пробе мочи прибавляли 200 мкл
концентрированной хлористоводородной кислоты, флакон укупоривали и выдерживали
при 100оС в течение 15 минут. После охлаждения к гидролизату
прибавляли порядка 250 мкл 10% раствора натрия гидроксида до рН 5-6 и 2 мл
1/15М фосфатного буфера pH6;
в) с применением ферментативного
гидролиза – к пробе мочи прибавляли 250
мкл 1/15М фосфатного буфера pH6 и 50 мкл β-глюкуронидазы, флакон укупоривали и
выдерживали при 45оС в течение 2 часов. После охлаждения к
гидролизату прибавляли 2 мл 1/15М фосфатного буфера pH6.
После проведения предварительных процедур а), б) или в) образцы мочи
центрифугировали при 3000 об/мин в течение 5 минут, центрифугаты отделяли от
осадков и подвергали ТФЭ по следующей схеме: кондиционирование сорбента проводили
путем последовательного пропускания через картридж 2 мл 95% этанола и 2 мл 1/15
М фосфатного буфера рН 6,0. Далее загружали образец со скоростью 1 мл/мин. Промывку
осуществляли последовательно: 2 мл 1/15 М фосфатного буфера рН 6,0, 2 мл 0,1 М раствора уксусной
кислоты и 2 мл 10% раствора этанола. Патрон сушили под вакуумом в течение 5
минут. Очистку производили первоначально пропусканием через сорбент 2 мл н-гексана.
Далее элюировали смесью н-гексан–этилацетат (3:1) дважды по 2 мл (элюат I). Затем вновь проводили очистку 2 мл метанола. Элюат II получали двукратным пропусканием через
патрон по 2 мл смеси дихлорметан–пропанол-2–25% аммиак (4:1:0,1), элюаты испаряли
в токе азота при 60оС.
Процедура метилирования: сухой остаток элюатов I и II
растворяли в 500 мкл безводного ацетона, раствор переносили в реакционную виалу
на 2 мл, в которую предварительно вносили 2 мг прокаленного калия карбоната. К
ацетоновому раствору прибавляли 40 мкл йодметана, и виалу плотно закрывали
винтовой крышкой и экспонировали в течение 45 минут при 60оС. После
охлаждения из виалы отбирали 200 мкл ацетонового раствора и испаряли в токе
азота при 60оС.
Полученные пробы мочи
после процедуры скрининга ацетилировали: к сухому остатку прибавляли 40 мкл
пиридина и 60 мкл уксусного ангидрида. Полученную смесь переносили в
реакционную виалу на 2 мл с винтовой крышкой, которую плотно закрывали и
подвергали воздействию МВИ мощностью 560 Вт в течение 5 минут. Избыток
реагентов удаляли в токе азота при 60оС. Аналогично проводили
процедуру ацетилирования для элюатов I и II после ТФЭ.
После дериватизации сухие
остатки растворяли каждый в 200 мкл безводного этилацетата и по 1 мкл полученного раствора последовательно вводили
в испаритель хромато-масс-спектрометра с использованием устройства для
автоматического ввода проб.
Режим работы автосамплера
включал следующие операции: пять промывок шприца этанолом; пять промывок
этилацетатом; одна промывка шприца раствором пробы; три прокачки раствором
пробы перед вводом ее в хромато-масс-спектрометр; набор и ввод пробы; пять
промывок шприца этанолом; пять промывок этилацетатом.
Режим работы газового
хроматографа с масс-селективным детектором.
Скорость потока газа-носителя (гелий) через колонку 1,5 мл/мин, режим
работы split/splitless (деление потока 15:1, с
задержкой включения 1 мин после ввода пробы). Температура испарителя хроматографа и
интерфейса детектора задавалась 250 и 280оС, соответственно.
Температура колонки начальная 70оС в течение 2 мин и прогрев до 280оС
со скоростью программирования 20 град/мин, выдержка при конечной температуре 8
мин. Напряжение на умножителе
масс-селективного детектора устанавливали на 200 В выше величины автоматической
настройки детектора. Регистрация масс-спектров в режиме полного сканирования
ионов в интервале масс 45 – 700 а.е.
Обработку хроматограмм с целью идентификации
компонентов проб проводили с использованием программы AMDIS (The Automatic Mass
Spectral Deconvolution and Identification System, NIST).
Обсуждение результатов
Основной трудностью в
идентификации МДПВ методом ГХ-МС является малоинформативный масс-спектр данного
соединения. Следовательно, для надёжной идентификации необходимо определение
сопутствующих данному веществу маркеров, то есть метаболитов, характерных для
МДПВ.
Сопоставляя данные по
метаболизму пролинтана и МДМА, можно предположить основные направления
метаболизма МДПВ. Первый путь – это окисление пирролидинильного заместителя в
положении 2, с образованием лактамного цикла, либо его дециклизация, аналогично
метаболизму пролинтана [5]. Второе направление – деалкилирование
метилендиокси-заместителя в бензольном кольце, с последующим метилированием
гидроксигруппы в положении 3, а так же образование конъюгатов для данной группы
метаболитов [2]. Возможны так же гидроксилирование алкильной цепи и
окислительное дезаминирование. На рис. 1 приведены идентифицированные в моче
потребителей метаболиты МДПВ.
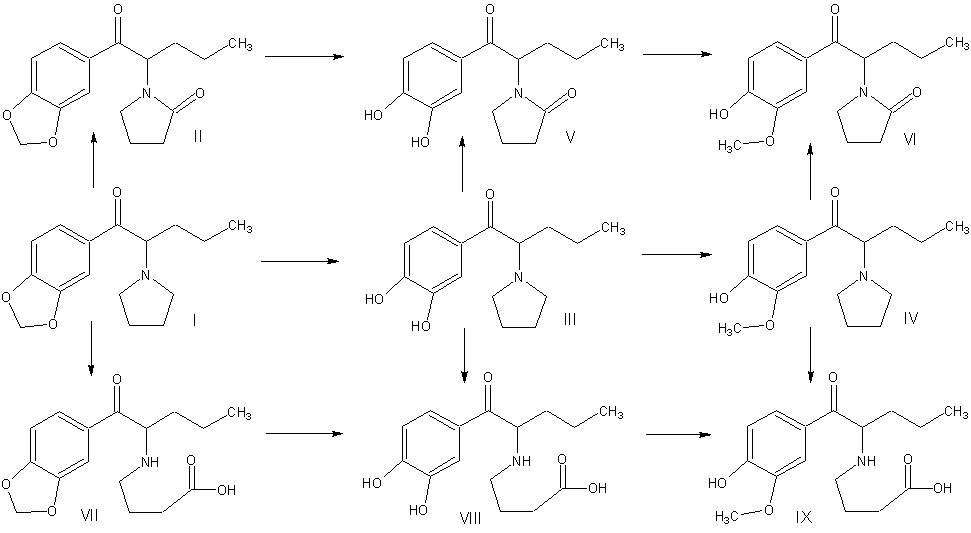
Рис.
1. Схема метаболизма метилендиоксипировалерона.
Соединения
идентифицированные в моче потребителей:
I –
1-(1,3-бензодиоксол-5-ил)-2-(1-пирролидинил)-1-пентанон (МДПВ);
II –
1-[1-(1,3-бензодиоксол-5-илкарбонил)бутил]-2-пирролидинон;
III – 1-(3,4-дигидроксифенил)-2-(1-пирролидинил)-1-пентанон;
IV –
1-(4-гидрокси-3-метоксифенил)-2-(1-пирролидинил)-1-пентанон;
V – 1-[1-(3,4-дигидроксибензоил)бутил]-2-пирролидинон;
VI –
1-[1-(4-гидрокси-3-метоксибензоил)бутил]-2-пирролидинон;
VII – 4-{[1-(1,3-бензодиоксол-5-илкарбонил)бутил]амино}бутановая
кислота; VIII – 4-{[1-(3,4-дигидроксибензоил)бутил]амино}бутановая кислота;
IX – 4-{[1-(4-гидрокси-3-метоксибензоил)бутил]амино}бутановая
кислота.
Первоначально
нами было изучено влияние гидролиза на разрушение конъюгированных метаболитов
МДПВ, с этой целью были исследованы извлечения из пробы мочи без гидролиза, с
кислотным и ферментным гидролизами. Общую оценку проводили путем внутренней
нормализации площадей пиков с величинами m/z 126 (соединения III, IV), m/z 140 (соединения V, VI) к пику с величиной m/z 126 МДПВ (площадь последнего
принимали за 100%). Твердофазная экстракция позволяет провести
фракционирование, то есть разделение нейтральных соединений II, V, VI и основных веществ МДПВ – III и IV. В таблице 2 приводятся данные о
зависимости выхода метаболитов МДПВ от способа пробоподготовки мочи (после
ацетилирования).
Таблица 2.
Оценка влияния способа
пробоподготовки на относительный выход метаболитов МДПВ
|
Процедура |
Фракция |
Содержание метаболитов относительно
МДПВ, % |
||||
|
III |
IV |
II* |
V* |
VI* |
||
|
Без гидролиза, ТФЭ |
1 |
н.о. |
н.о. |
9,6 |
н.о. |
6,5 |
|
2 |
н.о. |
4,4 |
200,5 |
н.о. |
н.о. |
|
|
Кислотный гидролиз, ТФЭ |
1 |
н.о. |
н.о. |
16,2 |
39,5 |
66,5 |
|
2 |
11,2 |
97,1 |
358 |
4,9 |
19,2 |
|
|
Ферментный гидролиз, ТФЭ |
1 |
н.о. |
н.о. |
22,6 |
40,2 |
241 |
|
2 |
467 |
304 |
3757 |
627 |
964 |
|
|
Скрининг** |
– |
0,5 |
4,9 |
57,4 |
9,6 |
14,7 |
* Для фракции 2 соединения II, V, VI фактически соответствуют количеству
соединений VII, VIII, IX, соответственно. Объяснение в тексте.
** Процедура кислотного гидролиза с
последующей ЖЖЭ.
Обращает на себя внимание
высокие выходы соединений II, V, VI во
фракции основных веществ. Изучение элюатов без дериватизации и с применением
различных методов дериватизации и их сочетания, показало, что соединения II, V, VI образуются вследствие
внутримолекулярной циклизации амфотерных соединений VII, VIII и IX в процессе ацетилирования и ГХ-МС
исследования. Причем,
ациклические метаболиты (VII – IX), образуют
цвиттер-ионы и не извлекаются из водной фракции методом ЖЖЭ в виду высокой
гидрофильности, в то время, как ТФЭ позволяет изолировать данные соединения.
В
таблице 3 приведены газохроматографические и масс-спектрометрические
характеристики МДПВ и производных некоторых метаболитов.
Таблица 3.
Газохроматографические и
масс-спектрометрические характеристики метаболитов МДПВ
|
Соединение |
М.м. |
Характеристические ионы; m/z (интенсивность, %) |
Время удерживания, мин |
Индекс удерживания |
|
I |
275 |
55 (4,1); 56 (1,3); 63 (2,6); 65 (4,6); 69 (2,6); 70 (1,8); 84 (3,5); 91 (1,5); 96 (3,8); 97 (3,6); 98 (1,4); 110 (1,2); 121 (3,4); 124 (1,6); 126 (100); 127 (12,2); 149 (5,1); 177 (0,3); 232 (0,7); 246 (0,1); 274 (0,1); 275 (0,1) |
11,54 |
2188 |
|
II |
289 |
55 (5,7); 63 (4,6); 65 (7,9); 69 (8,6); 70 (5,0); 86 (11,3); 91 (2,4); 98 (28,0); 121 (5,4); 140 (100); 141 (9,4); 149 (9,2); 206 (11,0); 221 (1,1); 246 (0,1); 260 (0,2); 289 (0,8) |
12,55 |
2420 |
|
III, диацетил- |
347 |
43
(10,2); 84 (2,5); 96 (2,5); 97 (2,4); 109 (0,9); 126 (100); 127 (9,6); 137 (2,8); 179 (0,4); 220 (0,2); 262 (0,3); 304 (0,3); 346 (0,1) |
12,56 |
2423 |
|
III, диметил- |
291 |
55
(4,3); 69 (2,3); 77 (2,2); 79 (2,4); 84 (2,3); 96 (2,7); 97 (2,4); 110 (1,0); 124 (1,8); 126 (100); 127 (9,2); 137 (0,8); 151 (0,4); 165 (2,4); 193 (0,2); 248 (0,3); 290 (0,1) |
11,85 |
2254 |
|
IV, ацетил- |
319 |
43
(4,6); 84 (2,4); 96 (2,8); 97 (2,8); 108 (1,0); 126 (100); 127 (9,3); 151 (2,6); 234 (0,2); 276 (0,4); 318 (0,1) |
12,14 |
2322 |
|
V, диацетил- |
361 |
65
(4,2); 69 (12,9); 72 (3,7); 86 (8,1); 98 (20,1); 123 (3,6); 140 (100); 151 (10,6); 193 (2,6); 250 (11,5); 251 (2,0); 319 (0,5); 361( 0,6) |
13,17 |
2561 |
|
V, диметил- |
305 |
51
(1,8); 56 (1,6); 69 (6,0); 70 (3,4); 72 (1,8); 77 (4,3); 79 (4,4); 86 (8,9); 92 (1,9); 94 (1,5); 98 (22,6); 107 (1,7); 122 (1,5); 137 (2,0); 140 (100); 141 (9,8); 151 (0,5); 165 (14,7); 166 (1,5); 193 (0,6); 222 (13,6); 223 (1,9); 262 (0,1); 276 (0,2); 305 (1,5) |
12,73 |
2463 |
|
VI, ацетил- |
333 |
55
( 2,6); 69 (4,3); 72 (1,2); 86 (7,3); 98 (18,4); 108 (1,2); 123 (2,6); 140 (100); 141 (9,2); 151 (6,9); 208 (0,6); 248 (0,2); 250 (4,9); 290 (0,6); 333 (0,2) |
12,89 |
2502 |
|
VII, диметил- |
335 |
44 (4,5); 59 (30,0); 65 (6,5); 70
(5,3); 84 (6,9); 86 (3,6); 91 (2,0); 98 (2,4); 101 (40,2); 102 (2,3); 121
(5,6); 135 (3,8); 149 (11,5); 150 (1,1); 172 (1,6); 186 (100); 187 (11,3) 205
(0,8); 248 (0,1); 260 (0,1); 262 (0,1); 292 (0,4); 304 (2,1); 334 (0,1) |
12,68 |
2450 |
|
VIII, тетраметил- (IX, триметил-) |
351 |
44
(2,8); 59 (21,6); 77 (2,9); 79 (3,1); 101 (29,7); 102 (19); 122 (2,4); 136 (1,8); 137 (1,9); 151 (2,7); 165 (6,7); 186 (100); 187 (10,3); 206 (0,7); 248 (0,6); 262 (0,6); 290 (0,6); 319 (0,7); 337 (0,3) |
12,91 |
2505 |
Из
приведенных данных следует, что как для группы метаболитов с незатронутым
пиррольным циклом и алкильной цепью (III, IV), так и для МДПВ, характерным
является ион с величиной m/z 126.
В случае лактамных метаболитов (II, V, VI) наблюдается базовый ион со значением m/z 140. Причем, вид дериватизации,
ацетилирование или метилирование, не приводит к значительному изменению
основных направлений масс-фрагментации соединений. При метилировании, в случае
соединений VII, VIII и IX наблюдается исчерпывающее
метилирование, то есть О- и N-алкилирование, при этом основным характеристическим
фрагментным ионом образовавшихся
производных является ион с величиной m/z 186. Попытка получения трифторацильных
производных посредством трифторуксусного ангидрида, как и в случае с
ацетилированием приводит к внутримолекулярной циклизации соединений VII, VIII и IX до II, V, VI, соответственно. Следует отметить,
что соединение II может использоваться как маркер приема МДПВ, так как он
обладает более специфичным масс-спектром с выраженными фрагментными ионами.
Выводы
1.
Описаны
основные пути метаболизма МДПВ в организме человека.
2.
Приведены
газохроматографические и масс-спектрометрические характеристики ацетильных и
метильных производных ряда метаболитов, которые могут быть использованы для
выявления пользователей МДПВ.
3.
Установлено,
что метаболиты МДПВ, выводящиеся с мочой, экскретируются, в основном, в виде
конъюгатов.
4.
Показана
возможность выявления МДПВ и его метаболитов в процедуре общего скрининга мочи.
5.
Метод
ТФЭ является оптимальным для извлечения метаболитов МДПВ, в особенности
амфотерных соединений (VII, VIII, IX), вносящих наибольший вклад в элиминацию МДПВ.
Cписок литературы
1.
Постановление
Правительства №681 от 30 июня
1998 г. «Об утверждении перечня наркотических средств, психотропных веществ и
их прекурсоров, подлежащих контролю в Российской Федерации».
2.
Baselt, R.C. Disposition of Toxic
Drug and Chemicals in Man / R.C. Baselt, R.H. Cravey – 4-d Ed. – California:
Chemical Toxicology Institute Forest City. – 1995. – P. 788.
3.
Deniker, P. Abuse of pyrovalerone by
drug addicts / P. Deniker, H. Loo, H. Cuche, J.M. // Roux Annales
Medico-Psychologiques. – 1975. – V.2. – N.4. – P.745-748.
4.
«Misuse of Drugs Act 1971» on 16th
April 2010.
5.
Vickers, S. The biotransformation of
nitrogen containing xenobiotics to lactams / S. Vickers, S.L. Polsky // Current
Drug Metabolism. – 2000. – V.1. – N.4. – P.357-389.
Катаев Сергей Сергеевич
E-mail: forenschemist@narod.ru