Выдержка
из Бутлеровские
сообщения. 2013. Т.34. №4. с. 116-122.
Идентификация
маркеров каннабимиметиков
PB-22 и PB-
Катаев С.С., Зеленина Н.Б., Дворская О.Н.
Описаны
маркеры,
позволяющие
установить факт
употребления
каннабимиметиков
PB-22 и PB-
Identification of PB-22 and PB-
Kataev S.S., Zelenina
N.B., Dvorskaya O.N.
Annotation
The article describes markers used for ascertining
the fact of usage of PB-22 and PB-
…
Подготовка
проб. К
пробам мочи
объемом по 0.5
мл
прибавляли
по 50 мкл
спиртовых
растворов
внутренних
стандартов: этилморфина
гидрохлорида
(0.02 мг/мл), N-этилбензиламина
(0.01 мг/мл) и гексенала
(0.2 мг/мл). Далее
проводили
предварительную
подготовку
образцов
одним из трех
способов:
…
·
С
применением
ферментативного
гидролиза. К
пробе мочи
прибавляли 250
мкл 1/15М
фосфатного
буфера pH 6 и 25 мкл β-глюкуронидазы,
флакон
укупоривали
и
выдерживали
при 45 оС
в течение 2
часов.
К
образцам
мочи без
гидролиза и
после гидролиза
прибавляли 2
мл 1/15 М
фосфатного
буфера (рН
4.8). Содержимое
флаконов
центрифугировали
при 3000 об/мин
в течение 10
минут, центрифугат
отделяли от
осадка.
Экстракцию
проводили на
патронах для
ТФЭ SampliQ EVIDEX (200 мг/3
мл) со
смешанной
фазой.
Кондиционирование
сорбента
проводили
путем
последовательного
пропускания
через
картридж 2 мл 95%
этанола и 2 мл 1/15
М фосфатного
буфера (рН
4.8). Далее
загружали
образец со
скоростью 1
мл/мин.
Промывку
осуществляли
последовательно:
1 мл 1/15 М
фосфатного
буфера (рН
4.8) и 1 мл 10%
этанола.
Сушка
патрона
осуществлялась
под вакуумом
в течение 10-15
минут. Элюат
I получали
двукратным
пропусканием
через патрон
смеси н-гексан–этилацетат
(3:1) по 2 мл. Элюат
II получали
двукратным
пропусканием
через патрон
смеси дихлорметан–изо-пропанол
– 25% аммиак (4:1:0.1) по
2 мл. Элюаты
I и II испаряли в
токе азота
при 40 оС.
Получение
производных
проводили по
одному из
вариантов,
указанных
ниже.
·
Метилирование. К сухому
остатку элюата
I
прибавляли 500
мкл
безводного
ацетона, 40 мкл
йодистого
метила и 20-25 мг
безводного
карбоната
калия,
герметично
закрывали и
нагревали
при 60 оС
в течение 60
минут в термоблоке.
Флакон
охлаждали,
отбирали
жидкую
фракцию
реакционной
смеси,
переносили в
чистую виалу
и испаряли в
токе азота
при 40 оС.
Сухой остаток
растворяли в
100 мкл
безводного
этилацетата
и 1 мкл
вводили в
испаритель
ХМС.
·
Ацетилирование. К сухому
остатку элюата
II
прибавляли 40
мкл
безводного
пиридина и 60
мкл
уксусного
ангидрида
(замывая
стенки виалы),
виалу
плотно
укупоривали
и
обрабатывали
микро-волновым
излучением в
СВЧ – печи с
мощностью 560
Вт в течение 5
минут. После
охлаждения
флакон вскрывали
и выпаривали
избыток
реагентов в
токе азота
(не выше 40 оС).
Сухой
остаток
растворяли в
100 мкл
безводного
этилацетата
и 1 мкл
вводили в
испаритель
ХМС.
·
Получение
триметилсилиловых
эфиров. К сухому
остатку элюата
I или II
прибавляли 100
мкл BSTFA,
содержащего
1% триметилхлорсилана,
герметично
закрывали,
перемешивали
на микро-встряхивателе
и нагревали
при 80 оС
в течение 60
минут в термоблоке.
Виалу
охлаждали и 2
мкл вводили в инжектор хромато-масс-спектрометра.
Режим
работы
газового
хроматографа
с масс-селективным
детектором.
Скорость
потока газа-носителя
(гелий) через
колонку 1.5
мл/мин, режим работы
split/splitless
(деление
потока 15:1, с задержкой
включения 1
мин после
ввода пробы).
Температура
испарителя
хроматографа
и интерфейса
детектора
задавалась 250
и 280 оС.
Температура
колонки
начальная 70 оС в
течение 2 мин
и прогрев до 280 оС со
скоростью
программирования
20 град/мин, выдержка
при конечной
температуре 8
мин.
Напряжение
на умножителе
масс-селективного
детектора
устанавливали
равной
величине
автоматической
настройки
детектора. Регистрация
масс-спектров
для
ацетильных и метильных
произ-водных
в режиме
полного
сканирования
ионов в интервале
масс 42-450 а.е.
Регистрация
масс-спектров
триметилсилильных
производных
в режиме
полного
сканирования
ионов в
интервале
масс 100-700 а.е.
…
Общая
химическая
структура
для каннабимиметиков
PB-22 и PB-

Рис.
1.
Химическая
структура каннабимиметиков
PB-22 и PB-
…
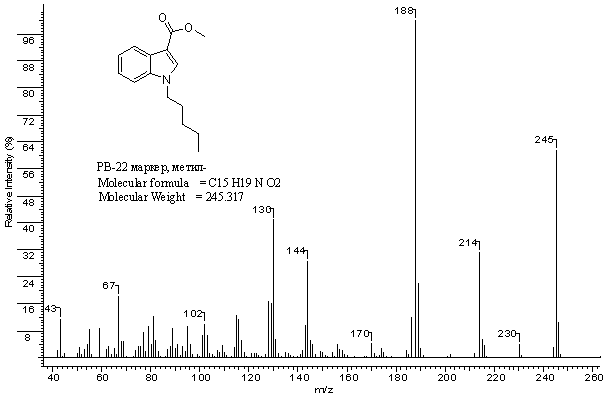
Рис. 2.
Масс-спектр
метилового
эфира
1-пентил-1H-индол-3-карбоновой
кислоты (метиловый
эфир маркера PB-22)
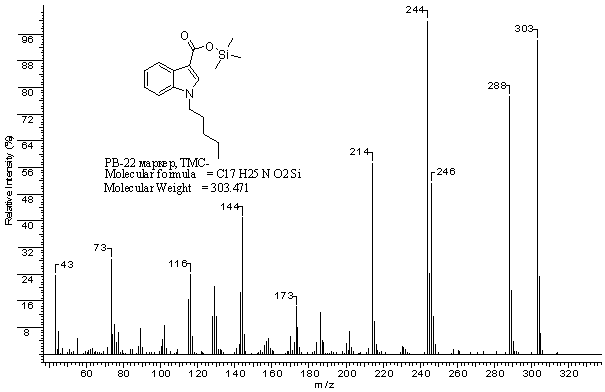
Рис. 3.
Масс-спектр триметилсилилового
эфира
1-пентил-1H-индол-3-карбоновой
кислоты (триметилсилильное
производное
маркера PB-22)
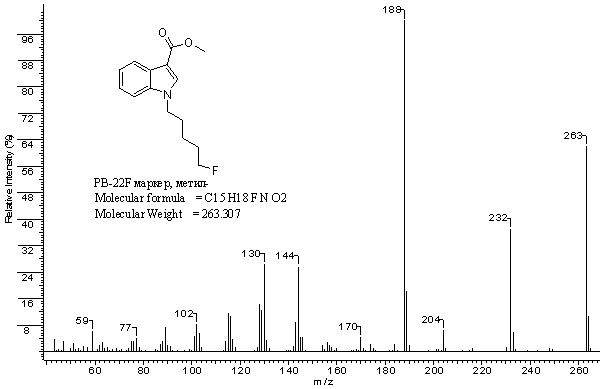
Рис. 4.
Масс-спектр
метилового
эфира
1-(5-фторпентил)-1H-индол-3-карбоновой
кислоты
(метиловый
эфир маркера PB-
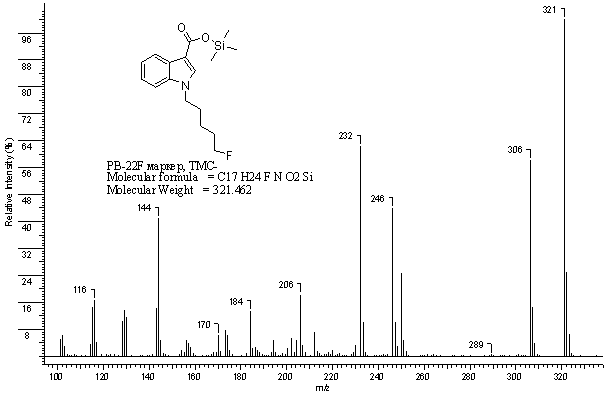
Рис. 5.
Масс-спектр триметилсилилового
эфира
1-(5-фторпентил)-1H-индол-3-карбоновой
кислоты (триметилсилильное
производное
маркера PB-
…
Исследование
13 образцов
мочи
потребителей
каннабимиметиков PB-
…
E-mail: forenschemist@narod.ru