Опубликована
в журнале Проблемы экспертизы в медицине, 2008, №1, с.37-40
УДК 340.67:543:615.214.24
Е.А. Шилова, С.С. Катаев, Н.Б.
Зеленина, Ю.А. Хомов, Е.И. Егорова, Н.В. Кокшарова
ИЗОЛИРОВАНИE ЗОЛПИДЕМА И ЕГО ОСНОВНОГО МЕТАБОЛИТА
МЕТОДОМ ТВЕРДОФАЗНОЙ ЭКСТРАКЦИИ
ГУЗОТ «Пермское краевое бюро
судебно-медицинской экспертизы»
(начальник –
В.И. Перминов)
ГОУ
ВПО ПГФА, Росздрава, Пермь, Россия (ректор – проф. Г.И. Олешко)
Настоящее
исследование посвящено поиску оптимальных условий извлечения золпидема и его основного метаболита, [6-метил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ил]уксусной
кислоты, образующейся в организме человека при гидролизе данного препарата.
Описаны основные условия проведения твердо-фазной экстракции, позволяющие
достичь эффективного извлечения этих двух компонентов при совместном
присутствии. Приведены газохроматографические и масс-спектрометрические данные золпидема и различных производных продукта его гидролиза,
которые могут быть использованы для их качественной идентификации в практике
судебно-химического и токсикологического
анализа.
Ключевые слова: Золпидем, продукт
гидролиза золпидема, твердофазная экстракция, степень
экстракции, газовая хроматография –масс-спектрометрия.
ISOLATION OF ZOLPIDEM AND ITS MAIN METABOLITE BY SOLID PHASE EXTRACTION
E.A. Shilova, S.S. Kataev, N.B. Zelenina, U.A. Homov, E.I. Egorova, N.V. Koksharova
The present study is devoted to search of the best
extraction conditions of Zolpidem and its main
metabolite, [6-methyl-2-(4-methilphenyl)imidazo[1,2-a]pyridine-3-yl]acetic acid, which is produced by hydrolysis in human
body. The procedure of Solid Phase Extraction have been shown to receiving the
best extractions results of these two compounds in the combined presence of them.
The basic data of gas chromatographic and mass-spectrometry of Zolpidem and various derivates of Zolpidem
hydrolysis form are described and can be used for
their qualitative identification in forensic and analytic toxicology.
Key words: Zolpidem, Zolpidem hydrolysis
form, Solid Phase Extraction, degree of extraction, gas chromatography –
mass-spectrometry.
Золпидем, синоним SL-80.0750,
химическое название N,N,6-триметил-2-(4-метилфенил)имидазо1D[1,2-а]пиридин-3-ацетамид. Его соль золпидема тартрат, синонимы SL-80.0750-23N, Zolpidem Hemitartrate, торговые наименования: Ивадал, Ambien, Bikalm, Cedrol, Dalparan, Ivadal, Niotal, Stilnoct, Stilnox.
Золпидем по химической структуре представляет собой
производное имидазопиридина; его фармаколгические
свойства выражаются в проявлении снотворного и седативного эффекта. Препарат избирательно
взаимодействует с первым подтипом бензодиазепиновых
рецепторов (BZ1,
или ω1-подтип) макромолекулярного
ГАМК-комплекса. Обладает также не ярко выраженными анксиолитическим, миорелаксирующим,
противосудорожным и амнестическим эффектами [1]. В отличие от ставших «классическими» снотворных – производных
барбитуровой кислоты и 1,4-бензодиазепина, золпидем
оказывает незначительное влияние на структуру сна, в чем и проявляется его
преимущество при лечении интрасомнических
расстройств, и, как следствие, ведет к все большему распространению применения
данного препарата населением за последние несколько лет, в том числе и на
территории Российской Федерации.
После применения «per os» адсорбируется порядка 70% [3]. Пик концентрации в плазме
достигается через 0,5 – 3 ч. На 92% связывается с белками плазмы. Препарат
показывает линейную фармакокинетику во всем диапазоне
терапевтических доз, и первично метаболизируется в
печени. Пути метаболизма включают окисление и гидроксилирование.
Неактивные метаболиты выводятся с мочой (56%) и калом (37%), менее чем 1% экскретируется в неизменном виде. Золпидем
выводится с грудным молоком и способен преодолевать гемато-плацентарный
барьер. Согласно данным L. Pichard с соавторами [10], биотрансформацию данного лекарственного средства
обеспечивает цитохром P450S гепатоцитов
человека; при чем практически полностью золпидем
преобразуется в [6-метил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ил]уксусную кислоту (рис. 1).
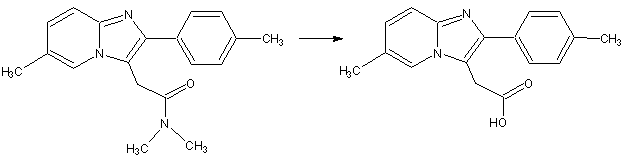
Рис.1. Образование основного метаболита золпидема
– [6-метил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ил]уксусной кислоты.
Рассмотрение золпидема как объекта судебно-химической экспертизы и
токсикологического анализа, несомненно, важно, с точки зрения потенциальной
опасности, сязанной со способностью препарата вызывать
при длительном приеме лекарственную зависимость, которая может повлечь за собой
злоупотребления данным лекарственным средством. В зарубежной литературе описаны случаи
отравлений золпидемом, в том числе и с летальным
исходом [4, 5, 7, 8, 9, 11, 12], а также существует информация по применению золпидема как средства, используемого для приведения
потерпевших в бессознательное состояние
и совершения противоправных действий [6].
Раннее нами было
исследованы особенности и закономерности экстракции золпидема
из водных растворов при использовании метода жидкость-жидкостной (ЖЖЭ) экстракции и твердофазной
экстракции (ТФЭ). Было показано
значительное преимущество твердофазной экстракции золпидема
с использованием патронов SPEC MP3 со смешанной фазой и SPEC C18 с обращенной фазой по сравнению с
извлечением данного препарата различными органическими растворителями. При этом
экстракция золпидема на патронах как SPEC MP3, так и SPEC C18 оказалась в равной степени
эффективна для данного вещества – выход
в обоих случаях был порядка 100% [2].
В настоящей работы мы
ставили своей целью изучение и поиск оптимальных условий для совместного
извлечения из водных растворов суммы веществ: золпидема
основания и его основного метаболита - [6-метил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ил]уксусной кислоты (ЗГ) с
применением ТФЭ и дальнейшим их определением методом газовой хроматографии –
масс-спектрометрии (ГХ/МС).
Оборудование
Использовали систему для ТФЭ с вакуумной камерой (манифолд) на 12 позиций. Идентификацию и количественное
определение проводили на газовом
хроматографе Agilent 6850, оснащенном
капиллярной кварцевой колонкой НР-5MS длиной 30 м с внутренним
диаметром 0,25 мм и толщиной пленки 0,25 мкм. Газовый хроматограф был сопряжен
с масс-селективным детектором Agilent 5973N (Agilent, США). Так же применяли термоблок ПЭ-4030, микровстряхиватель
ПЭ-2 (ОАО «Экрос»,
Россия), микроволновую печь Rolsen MS1770SA («Россия»)
и полуавтоматические пипетки-дозаторы, позволяющие отбирать объемы жидкостей
4-40, 40-200, 200-1000 мкл и 1-5 мл.
Материалы и методы
Применяли
диски SPEC MP3 – 30 мг (Varian, Inc); золпидема
тартрат (порошок-субстанция, Испания, НД
42-13447-05); реланиум (ампулы, 2 мл с содержанием диазепама – 5 мг/мл, Polfa, Польша); 2,2,3,3,3-пентафторпропанол
и пентафторпропионовый ангидрид («ICN Biomedicals»). Все используемые растворители и реактивы имели чистоту
х.ч.
Образец ЗГ с концентрацией 0,2 мг/мл получали путем
щелочного гидролиза золпидема: в реакционную
виалу на 2 мл помещали 110 мкл спиртового раствора золпидема гидротартрата в
пересчете на основание и испаряли в токе азота при 60 оС.
К сухому остатку прибавляли 500 мкл 0,1М натрия гидроксида,
герметично закрывали и помещали в термоблок;
экспозиция 50 часов при 100 оС. По истечении указанного времени гидролизат охлаждали и подвергали твердофазной экстракции
на патроне SPEC MP3 с привитой смешанной фазой. Процедура ТФЭ проведена по
протоколу 2 (таблица 1). Полученный элюат переносили
в виалу на 2 мл и испаряли в токе азота при 60 оС. Раствор ЗГ готовили в ацетонитриле
с учетом эффективности экстракции (80%). Полноту гидролиза контролировали
методом ГХ/МС.
Пробы
готовили прибавлением к 1 мл дистиллированной воды 20 мкл спиртового раствора золпидема основания с концентрацией 0,05 мг/мл и 20 мкл
раствора продукта гидролиза золпидема в ацетонитриле с концентарцией 0,05 мг/мл и испаряли до сухого остатка.
Для создания
в водном растворе проб
различных значений концентрации ионов водорода использовали:
A. 1/15 М фосфатный буфер рН 6,0 (буфер А);
Б. 0,1 М ацетатный буфер рН 4,6 (буфер Б);
B. 0,1 М раствор уксусной кислоты рН 2,4 (раствор В).
Для каждого значения рН готовили по три пробы.
В качестве
элюента для дисков SPEC МР3 использовали смесь дихлорметан
– 2-пропанол – 25% водный раствор аммиака (80:20:2). Элюаты
выпаривали в токе азота при 60 оС до
сухого остатка.
Таблица 1. Протоколы твердофазной
экстракции на дисках SPEC MP3
|
Этап |
Процедуры ТФЭ |
||
|
Протокол 1 |
Протокол 2 |
Протокол 3 |
|
|
Подготовка образца |
1 мл буфера А |
1 мл буфера Б |
1мл раствора В |
|
Кондиционирование |
0,5 мл этанола; 0,5 мл буфера А |
0,5 мл этанола; 0,5 мл буфера Б |
0,5 мл этанола; 0,5 мл раствора В |
|
Загрузка образца |
со скоростью 1 мл/мин |
||
|
Промывка |
0,5 мл буфера А |
0,5 мл буфера Б |
0,5 мл раствора В |
|
Элюирование |
2 х 0,5
мл элюента |
||
Процедура дериватизации. К сухим остаткам в реакционных виалах на 2 мл
прибавляли по 25 мкл пентафторпропанола и 75 мкл пентафторпропионового ангидрида, герметично закрывали.
Далее пробы подвергали СВЧ-излучению мощностью 560 Вт
в течение четырех минут. После охлаждения растворов виалы
вскрывали, а их содержимое испаряли в токе азота при 60 оС.
К сухому остатку прибавляли 200 мкл этилацетата, содержащего 1 мкг/мл диазепама. 1 мкл раствора вводили в инжектор хроматомасс-спектрометра.
Количественную оценку эффективности ТФЭ определяли по результатам ГХ/МС
исследования трех параллельных проб.
Режим работы газового хроматографа с масс-селективным детектором.
Скорость потока
газа-носителя (гелий) через колонку 1,5 мл/мин. Режим работы split/splitless (деление потока
15:1 с
задержкой включения 1 мин после ввода пробы). Температура испарителя
хроматографа и интерфейса детектора - 300 и 280оС, соответственно.
Температура колонки: начальная 70оС в течение 1 мин и прогрев до 230оС
со скоростью программирования 40 град/мин, затем прогрев до 300оС со
скоростью программирования 20 град/мин; выдержка при конечной температуре 2,5
мин. Напряжение на умножителе масс-селективного детектора устанавливали на 200 В выше значения величины автоматической настройки
детектора. Регистрация масс-спектров в режиме селективного ионного мониторинга (SIM) по ионам с величинами m/z для диазепама
256, 283; для золпидема – 235, 307, 219; для пентафторпропилового эфира продукта гидролиза золпидема – 235; 412; 219.
Обработку хроматограмм проводили с использованием программы ChemStation G1701DA.
Результаты расчетов физико-химических
констант (LogP, pKa)
получены с использованием "ACD/I-Lab service" (Advanced Chemistry Development Inc., Toronto, Canada) по программе ACD/LogP v4.5, ACD/pKa v4.56.
Результаты и их обсуждение
Главным направлением биотрансформации
золпидема в организме человека является его ферментативный
гидролиз по амидной связи, ведущий к образованию основного его метаболита, не
обладающего фармакологической активностью – [6-метил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ил]уксусной кислоты. Золпидем и продукт его гидролиза обладают разными физико-химическими
свойствами, и, прежде всего, они отличаются по базовым количественным показателям,
играющим решающую роль при проведении
ТФЭ, какими являются показатели распределения н-октанол/вода
(Log P) и кислотности (pKa). Золпидем, согласно данным
характеристикам (таблица 2), проявляет свойства липофильного
соединения с умеренно слабыми основными свойствами; а продукт его гидролиза – липофильное соединение, обладающее амфотерными
свойствами, являясь карбоновой кислотой и слабым основанием.
Таблица 2. Физико-химические
константы золпидема и продукта его гидролиза
|
Показатели |
Золпидем |
ЗГ (расчет) |
|
|
литературные данные [3] |
расчет |
||
|
pKa |
6,2 |
5,37±0,70 |
6,43±0,70 |
|
pKa (-COOH) |
– |
– |
3,65±0,10 |
|
Log P |
3,85 |
2,35±0,63 |
2,82±0,61 |
В соответствии с этими данными, для проведения ТФЭ
описываемых выше соединений были применены патроны с привитой смешанной фазой SPEC MP3, которые обеспечивают экстракцию золпидема и продукта его гидролиза, за счет ионных
взаимодействий и сорбционных явлений.
В данных экспериментальных условиях для создания оптимального
режима экстракции двух компонентов, проявляющих различные свойства,
немаловажную роль играет выбор наиболее подходящего значения концентрации
водородных ионов в матрице. Мы исследовали экстракцию золпидема
и продукта его гидролиза при трех значениях pH водных растворов (при pH 2,4; 4,6; 6,0) путем добавления в
растворы модельных образцов 0,1 М уксусной кислоты, 0,1 М ацетатного буфера и
1/15 М фосфатного буфера соответственно. Эффективность экстракции золпидема и продукта его гидролиза (R) из водных растворов вычисляли, основываясь
на положении, что величина степени экстракции определяется отношением
количества (Q) исследуемого компонента, извлеченного из матрицы с использованием
одного из анализируемых методов, к общему (исходному) количеству его в матрице:
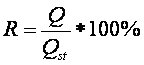
![]()
R
– эффективность экстракции, %;
Q – количество золпидема,
извлеченного из матрицы;
Qst –
количество золпидема в стандартном образце.
При количественной оценке результатов экстракции методом
ГХ/МС использовались газохроматографические и
масс-спектральные характеристики золпидема, пентафторпропилового эфира продукта гидролиза золпидема и диазепама, который
был применен в качестве внутреннего стандарта (таблица 3).
Таблица 3. Хромато-масс-спектрометрические характеристики золпидема, пентафторпропилового
деривата продукта гидролиза золпидема и диазепама
|
Соединение |
Характеристические ионы m/z, а.е. (интенсивность, %) |
Время удерживания
|
Индекс удерживания |
||
|
Диазепам* |
256 |
283 (93) |
– |
8,14 мин. |
2534 |
|
Золпидем |
235 |
307 (12) |
219 (11) |
9,61 мин. |
2908 |
|
Пентафторпропи-ловый эфир ЗГ |
235 |
412 (25) |
219 (9) |
7,92 мин. |
2482 |
* Внутренний стандарт
Для количественного
определения содержания золпидема, пентафторпропилового
эфира ЗГ и диазепама в пробах использовали
соотношение площадей пиков ионов с величинами m/z: 235 и 256.
Результаты изолирования золпидема и
продукта его гидролиза из водных растворов, в концентрации по 1 мкг при
различных значениях pH представлены таблице 4.
Таблица 4. Степень извлечения золпидема и
продукта его гидролиза
|
Проба |
pH 2,4 |
pH 4,6 |
pH 6,0 |
|||
|
золпидем |
ЗГ |
золпидем |
ЗГ |
золпидем |
ЗГ |
|
|
1 |
56,2 |
83,7 |
99,5 |
70,4 |
95,8 |
31,3 |
|
2 |
51,0 |
70,6 |
91,5 |
89,3 |
96,5 |
37,5 |
|
3 |
51,8 |
85,7 |
– |
– |
102,8 |
30,6 |
|
|
53 ± 3 |
80 ± 8 |
95 ± 6 |
80 ± 13 |
98 ± 4 |
33 ± 4 |
При оценке полученных данных видно (рис. 2), что наиболее
полный процент выхода обоих компонентов наблюдается при использовании ацетатного
буфера (pH 4,6) (таблица 1, протокол 2). Изменение водородного показателя в сторону
увеличения щелочности (pH 6,0) приводит к снижению степени экстракции продукта
гидролиза золпидема на 59% (таблица 1, протокол 1).
При чем, экстракция золпидема,
как при pН 4,6, так и при pH 6,0, была одинаково высокой.
Увеличение концентрации водородных ионов приводит к проявлению обратной
зависимости – значительному (в среднем в два раза) снижению степени экстракции золипидема, при этом, процент выхода продукта гидролиза не
изменился, ТФЭ для этого компонента при данных условиях оставалась
высокоэффективной (таблица 1, протокол 3).
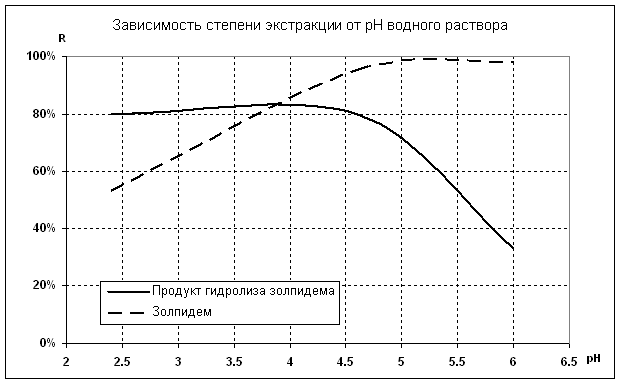
Рис.2. Зависимость степени экстракции золпидема
и продукта его гидролиза от рН водного раствора.
Нами были получены различные производные ЗГ,
газохроматографические и масс-спектральные характеристики которых, могут быть
использованы для качественной идентификации продукта гидролиза золпидема (таблица 5).
Таблица 5. Хромато-масс-спектрометрические характеристики производных
продукта гидролиза золпидема
|
Производное ЗГ |
Характеристические ионы m/z, а.е. (интенсивность, %) |
Время* удерживания
|
Индекс удерживания |
|
Метиловый эфир |
235(100), 294(24), 219(12) |
13,76 мин. |
2673 |
|
Этиловый эфир |
235(100), 308(27), 219(11) |
13,96 мин. |
2711 |
|
Изо-пропиловый эфир |
235(100), 322(19), 219(9) |
13,93 мин. |
2705 |
|
Пентафторпропиловый эфир |
235(100), 412(25), 219(9) |
12,81 мин. |
2482 |
|
Триметилсилильный эфир |
235(100), 352(16), 219(10) |
13,76 мин. |
2677 |
* Времена удерживания приведены для режима работы
колонки начальная температура 70оС
в течение 2 мин и прогрев до 280оС со
скоростью программирования 20 град/мин, выдержка при конечной температуре 8
мин.
Метильное и изо-пропильное
производные продукта гидролиза золпидема получали
обработкой образца метилйодидом или изо-пропилйодидом соответственно, в среде безводного
ацетона в присутствии безводного карбоната калия с экспозицией 45 минут при 60 оС.
Этильное производное
продукта гидролиза золпидема получали обработкой
смесью пентафторпропионового ангидрида с этанолом и
действием СВЧ-излучения мощностью 560 Вт в течение 4
минут.
Триметилсилильное производное
получали обработкой продукта гидролиза золпидема BSTFA, содержащего 1% триметилхлорсилана.
Во всех случаях в масс-спектрах производных ЗГ, а также золпидема, наблюдается базовый ион с величиной m/z 235 а.е.
Выводы
1. Золпидем и основной
его метаболит, [6-метил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ил]уксусная
кислота, с достаточно высокой степенью эффективности извлекаются из водных
растворов методом ТФЭ с применением патронов SPEC MP3 со смешанной привитой фазой при pH 4,6.
2. Предложенный вариант выделения позволяет
достичь степени экстракции золпидема и продукта его
гидролиза на 95% и 80% соответственно. Таким образом, описанные выше условия
проведения ТФЭ являются оптимальным для извлечения указанных компонентов при их
совместном присутствии.
3. Описанные газохроматографические и масс-спектральные характеристики золпидема и различных производных продукта его гидролиза могут быть применены для качественной идентификации этих соединений при проведении судебно-химического и химико-токсикологического анализа.
Cписок
литературы
1. Харкевич Д.А. Фармакология / Д.А. Харкевич – М.: ГЭОТАР-Медиа,
2006. – С. 187-188.
2.
Шилова
Е.А. Исследование экстракции золпидема из водных
растворов / Е.А. Шилова, С.С. Катаев,
Н.Б. Зеленина, Ю.А. Хомов, Е.И. Егорова, Н.В. Кокшарова // Достижения и перспективы в области создания
новых лекарственных средств: Материалы Российской научно-практической
конференции, посвященной 70-летию ПГФА
(27-28 ноября
2007 г.;
г. Пермь). – Пермь, 2007. – С. 236-241.
3.
Clarke's
Analysis of Drugs and Poisons.
4.
Gock S.B. Acute zolpidem overdose –
report of two cases / S.B. Gock,
S.H. Wong.,
5.
Keller T. GC/MS determination of zolpidem in postmortem specimens in a voluntary
intoxication / T. Keller, A. Schneider, E. Tutsch-Bauer
// Forensic Sci. Int. – 1999. –
Vol. 106. – №2. – P. 103-108.
6.
Kintz
P. Drug-facilitated sexual assualt and analytical
toxicology: the role of LC-MS/MS A case involving zolpidem
/ P. Kintz, M. Villain, V. Dumestre-Toulet,
etc. // J. Clin. Forensic Med. –
2005. – Vol. 12. – №1.
– P. 36-41.
7.
Levine B. Zolpidem
distribution in postmortem cases / B. Levine, S.C. Wu, J.E.
Smialek // J. Forensic Sci.
– 1999. – Vol. 44. – №2. – P. 369-371.
8.
Lichtenwalner
M. A fatality involving zolpidem / M. Lichtenwalner, R. Tully // J. Anal. Toxicol. –
1997. – Vol. 21. – №7.
– P. 567-569.
9.
Meeker J.E.
Zolpidem tissue concentrations in a multiple drug
related death involving Ambien / J.E.
Meeker, C.W. Som, E.C. Macapagal, etc. // J. Anal. Toxicol. – 1995. – Vol. 19. – №6. – P. 531-534.
10. Pichard L. Oxidative
metabolism of zolpidem by human liver cytochrome P450S / G. Gillet,
C. Bonfils, J. Domergue,
J.P. Thenot, P. Maurel // Drug
Metabolism and Disposition. – 1995.
– Vol. 23. – №11. – P. 1253-1262.
11. Winek C.L.
Acute overdose of zolpidem / C.L.
Winek, W.W. Wahba, J.K. Janssen, etc. // Forensic Sci.
Int. – 1996. – Vol. 78. – №3.
– P. 165-168.
12. Wyss P.A. Acute ovedose of Zolpidem / P.A. Wyss, D. Radovanovic, P.J.
Meier-Abt // Schweiz. Med. Wochenschr. – 1996. – Vol. 126. – №18. – P. 750-756.
Примечание: в таблице 5 в журнальном варианте статьи для метилового и пентафторпропилового эфиров ЗГ
приведены времена удерживания в режиме работы колонки приведённом в
экспериментальной части.
Катаев
Сергей Сергеевич
E-mail: forenschemist@narod.ru