Полная версия статьи опубликована в «Журнале аналитической химии», 2007, том 62, №5, с. 510-514.
УДК 543.544.45:543.51
ХРОМАТО-МАСС-СПЕКТРОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ЗОПИКЛОНА В МОЧЕ
© С.С. Катаев*, Н.Б. Зеленина*, Ю.А. Хомов**, Н.В. Кокшарова**, М. Дайех**
*Пермское
областное бюро судебно-медицинской экспертизы
614077, г.
Пермь, ул. Старцева, 61
**Пермская государственная фармацевтическая академия
614000, г. Пермь, ул. Ленина, 48
Описан метод количественного определения зопиклона и суммы его основных метаболитов в моче с использованием
газовой хроматографии с масс-спектрометрическим детектированием по общему
для них продукту гидролиза – 6-(5-хлор-2-пиридил)-7-гидрокси-6,7-дигидро-5Н-пиррол[3,4-b]пиразин-5-ону. Метод
характеризуется высокой чувствительностью. Предельно обнаруживаемая
концентрация в режиме полного сканирования ионов в интервале масс 45-450 а.е. составляет 70 нг/мл. Приведены
хромато-масс-спектрометрические данные различных производных продукта гидролиза
зопиклона, которые могут применяться для качественной
идентификации этого соединения. Исследована сохраняемость
зопиклона и его метаболитов при хранении в течение 1,
3 и 6 месяцев образцов мочи лиц, принимавших терапевтические дозы этого
вещества.
Зопиклон, синоним RP-27267, торговые наименования: Имован, Imovan, Rhovane, Sopivan, Zimovane, Zopiclone. Химическое название: 6-(5-хлор-2-пиридил)-7-оксо-6,7-дигидро-5Н-пиррол[3,4-b]пиразин-5-ил-4-метил-1-пиперазинкарбоксилат, является снотворным средством средней продолжительности действия. Ускоряет наступление сна и увеличивает его продолжительность [1]. Биодоступность при приеме per os порядка 80%; связь с белками плазмы от 45 до 80%; период полувыведения (Т1/2) от 3.5 до 6.5 часов [2-4]. Зопиклон быстро и широко распределяется в тканях, включая мозг. Метаболизирует в печени с образованием неактивного N-дезметильного производного и активного N-оксида зопиклона. Выводится с мочой, слюной и грудным молоком. Менее 7% препарата выводится в неизменном виде почками. Порядка 30% принятой дозы выводится с мочой в виде N-дезметилзопиклона и N-оксида зопиклона.
…
Нами разработан метод идентификации и
количественного определения суммы зопиклона и его
основных метаболитов в моче по общему для них продукту гидролиза – 6-(5-хлор-2-пиридил)-7-гидрокси-6,7-дигидро-5Н-пиррол[3,4-b]пиразин-5-ону с использованием хромато-масс-спектрометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Использовали газовый хроматограф Agilent 6850 с масс-селективным детектором Agilent 5973N (Agilent, США) и капиллярной кварцевой колонкой НР-5MS длиной 30 м с внутренним диаметром 0.25 мм и толщиной пленки неподвижной фазы 0.25 мкм. В работе применяли также термоблок ПЭ-4030 (ОАО “Экрос”, Россия) и рН-метр HI 1290 (Португалия). Полуавтоматические пипетки-дозаторы, позволяющие отбирать объемы жидкостей 0.004-0.04, 0.04-0.2, 0.2-1.0 мкл и 1.0-5.0 мл.
Материалы. Все используемые растворители и
реактивы имели чистоту х.ч. Использовали также этилморфина
гидрохлорид (ГФ X, ФС 41) и зопиклон
(порошок-субстанция, Испания, НД
42-10257-99). Исследовали образцы мочи двух добровольцев после приема per os терапевтической дозы 7.5 мг зопиклона. Моча
субъекта А общим объемом 460 мл была получена спустя
10 часов после приема. Моча субъекта Б общим объемом
195 мл была получена через 12 часов после приема. Образцы мочи хранились при +4оС.
Пробоподготовка мочи. 2 мл мочи помещали в стеклянный
флакон объемом 10 мл, вносили 50 мкл спиртового раствора этилморфина
гидрохлорида с концентрацией 0.02 мг/мл (внутренний стандарт) и добавляли 0.4
мл концентрированной хлористоводородной кислоты. Флакон плотно укупоривали и
выдерживали в термоблоке при 100оС
в течение 5 мин. Флакон охлаждали, прибавляли к гидролизату
25% раствор аммиака до рН 9-10 (по универсальной
индикаторной бумаге) и экстрагировали смесью хлороформ – 1-бутанол (6:1) дважды
по 5 мл. Экстракты фильтровали через бумажный фильтр с небольшим количеством
безводного сульфата натрия. Полученные растворы выпаривали до сухого остатка в
токе теплого воздуха. К сухому остатку прибавляли 40 мкл пиридина и 60 мкл
уксусного ангидрида. Полученную смесь переносили в сосуд на 2 мл для
аналитических проб, который плотно укупоривали и выдерживали в термоблоке при 80оС в
течение 25 мин. Избыток реагентов удаляли в токе теплого воздуха. Сухой остаток
растворяли в 200 мкл безводного этилацетата и 1 мкл полученного раствора
вводили в хромато-масс-спектрометр с использованием
устройства для автоматического ввода проб.
…
Режим
работы хромато-масс-спектрометра был
следующим. Скорость потока газа-носителя (гелий) через колонку составляла 1.5
мл/мин, режим работы узла ввода пробы включал деление
потока 1:10 с задержкой включения на 1
мин после ввода пробы. Температура узла
ввода пробы и линии соединения с масс-спектрометром 250 и 280оС.
Начальная температура колонки была 70оС в
течение 2 мин и далее колонку нагревали до 280оС
со скоростью 20 град/мин с выдержкой при конечной температуре 8 мин. Напряжение
на умножителе масс-селективного детектора
устанавливали на 200 В выше величины, полученной при
проведении стандартной автоматической настройки детектора. Регистрацию
масс-спектров проводили в режиме полного сканирования ионов в интервале
массовых чисел 45-450 а.е.
Градуировочный график зависимости соотношения
площади ацетилированного продукта гидролиза зопиклона к площади внутреннего стандарта от концентрации зопиклона строили с использованием результатов анализа интактной мочи, к которой добавляли спиртовой раствор зопиклона.
Использовали образцы мочи с концентрацией зопиклона: 0.1; 0.5; 1.0; 5.0; 10.0 мкг/мл. Для каждой калибровочной точки
проводили по три определения. Пробоподготовку
осуществляли по описанной общей схеме анализа. Хромато-масс-спектрометрическое
исследование калибровочных проб проводили в режиме селективного ионного
мониторинга. Характеристические ионы для определения ацетилированного продукта гидролиза зопиклона
с величинами m/z: 261, 263, 304, для ацетилированного
этилморфина – (внутреннего стандарта) m/z: 296, 355.
Градуировочный
график строили с использованием площадей пиков ионов на хроматограммах
с величинами m/z 261 и 296. Параметры удерживания были следующими: ацетилированный продукт гидролиза зопиклона
12.81 мин (индекс удерживания – RI 2480), ацетилированный этилморфин 13.63
мин (индекс удерживания – RI
2647). График был линейным во всем
изученном диапазоне концентраций.
Коэффициент корреляции составил 0.996.
Предельно
обнаруживаемая концентрация в режиме полного сканирования ионов в интервале
масс 45-450 а.е. составляла 70 нг/мл, а в
режиме селективного ионного мониторинга - 40 нг/мл.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Термическая и химическая лабильность зопиклона создает серьезные трудности при выполнении анализа с применением газовой хроматографии. На результаты оказывают влияние факторы пробоподготовки (рН среды, растворитель пробы и др.), температурные режимы узла ввода и колонки, эффекты старения колонки и загрязнения узла ввода.
…
Перспективные для анализа соединения,
образующиеся при гидролизе зопиклона (I) и его основных метаболитов (II, III),
представлены на рис. 1.
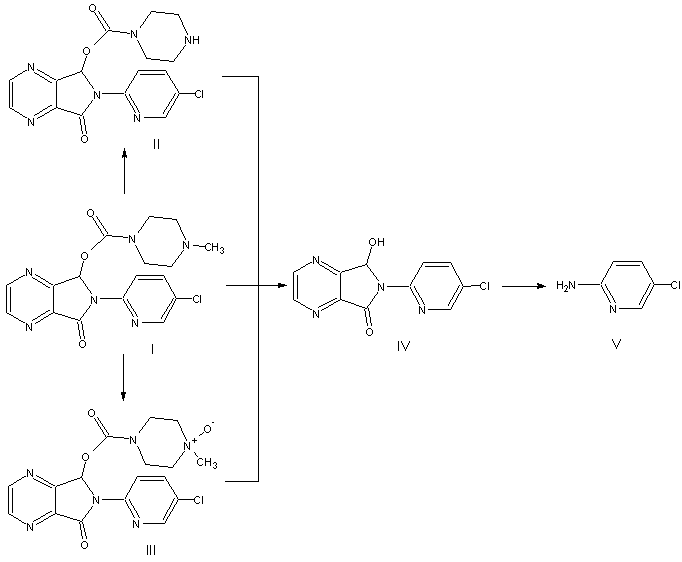
Рис.1. Схема метаболизма и поэтапного гидролиза зопиклона и его метаболитов. I – зопиклон; II – N-дезметилзопиклон; III – N-оксид зопиклона; IV – 6-(5-хлор-2-пиридил)-7-гидрокси-6,7-дигидро-5Н-пиррол[3,4-b]пиразин-5-он; V – 2-амино-5-хлорпиридин.
…
Протон гидроксильной группы соединения (IV) обладает «кислыми» свойствами. Одним из следствий активности этого протона является то, что продукт гидролиза зопиклона (IV) обладает плохими газохроматографическими характеристиками, образуя сильно уширенный пик. Это определяет необходимость перевода его в производные для дальнейшего анализа. Учитывая свойства данной гидроксильной группы, могут использоваться процедуры алкилирования, ацилирования и силилирования. В табл. 2 приведены соответствующие данные для зопиклона, соединений (IV) и (V), и их производных.
Таблица 2.
Хромато-масс-спектрометрические
характеристики зопиклона, соединений (IV, V) и их
производных.
|
Соединение |
[М]+ |
Характеристические
ионы m/z, а.е.
(интенсивность, %) |
tуд., мин. |
RI
|
|
I |
нет |
143(100); 245(47);
99(27); 56(21); 112(20); 247(17);
217(17); 139(15); 70(10) |
18.84 |
3205 |
|
IV |
262(27)/264(8) |
155(100); 233(44); 112(42); 234(34); 157(32); 191(22);
52(21); 261(19); 235(19) |
12.71 |
2456 |
|
IV, пентафторпропионат |
408(35)/410(10) |
261(100); 245(60); 217(51); 112(48); 139(34); 263(33);
247(21); 76(19); 219(17); 114(16); 246(15); 262(14) |
11.47 |
2167 |
|
IV, метил- |
276(9)/278(3) |
246(100); 261(71); 217(56); 112(48); 247(46); 248(37);
191(26); 139(24); 263(24); 245(21) |
12.45 |
2395 |
|
IV, триметилсилил- |
334(11)/336(4) |
319(100); 321(37); 320(20); 245(19); 112(19); 73(15);
217(14); 139(13); 305(13) |
12.57 |
2424 |
|
IV, ацетил- |
304(12)/306(3) |
261 (100); 155 (51); 262 (51); 263 (39); 112 (35); 233
(23); 245 (19); 217 (21) |
12.81 |
2480 |
|
IV, пентафторбензил- |
442(0.5)/444(0.2) |
246(100); 181(63); 217(34); 248(33); 112(29); 191(29); 261(19); 247(16); 139(12); 219(11); 76(11) |
14.90 |
2844 |
|
V |
128(100)/130(35) |
101(74); 103(21) |
5.90 |
1206 |
|
V, ацетил- |
170(21)/172(7) |
128(100); 101(21); 130(30) |
7.69 |
1462 |
…
Таким образом, предлагаемая схема исследования включает кратковременный кислотный гидролиз пробы мочи, экстракцию смесью хлороформ – 1-бутанол (6:1) при рН 9 и ацетилирование полученного экстракта. Применение режима полного сканирования ионов для масс-селективного детектора позволяет частично реализовать процедуру скрининга для лекарственных и наркотических веществ в моче [7, 9, 10]. При этом удается значительно повысить чувствительность к зопиклону в сумме с его основными метаболитами.
В отличие от описанной схемы, использование в качестве определяемого соединения 2-амино-5-хлорпиридина осложняется повышенной чувствительностью последнего к качеству газохроматографической колонки, причем после ацетилирования хроматографические характеристики соединения (V) еще более ухудшаются, что приводит к значительному уширению пика.
…
Таким образом, в результате
проведенных исследований разработан метод идентификации и количественного
определения суммы зопиклона и его основных метаболитов
в моче с использованием хромато-масс-спектрометрии,
характеризующийся высокой чувствительностью. Отмечена эффективность применения
кратковременного гидролиза для получения 6-(5-хлор-2-пиридил)-7-гидрокси-6,7-дигидро-5Н-пиррол[3,4-b]пиразин-5-она (IV), производные которого могут использоваться для
дальнейшего анализа. Приведены хромато-масс-спектрометрические данные различных
производных соединения (IV), которые
могут применяться для качественной идентификации зопиклона
и его основных метаболитов. Исследована сохраняемость
зопиклона и его метаболитов при хранении реальных
образцов мочи в течение 6 мес. при температуре +4оС.
Список литературы
[1] Машковский М.Д. Лекарственные средства. Т.1. М.:
«Новая волна», 2000. С.32.
[2]
Clarke's
Analysis of Drugs and Poisons.
[3]
Fernandez C, Martin C, Gimenez F,
Farinotti R. // Clin.
Pharmacokinet. 1995. V.29. N.6.
P.431-441.
[4]
Gaillot J., Heusse D., Hougton G.W. et al. // Pharmacology. 1983. V.27. Suppl.2. P.76-91.
[5]
Nordgren H.K., Bodin K., Beck O.
// Ther. Drug. Monit. 2002. V.24. N.3. P.410-416.
[6] Хомов Ю.А., Кокшарова Н.В., Дайех М., Гаранин В.П. // Проблемы экспертизы в медицине. 2004. N.1.
С.25-27.
[7]
Bickeboeller-Friedrich J.,
Maurer H.H. // Ther.
Drug. Monit. 2001. V.23. N.1.
P.61-70.
[8]
[9]
Мелентьев А.Б. Практическое руководство по скринингу лекарственных,
наркотических веществ и их метаболитов методом газовой хроматографии с масс-селектвным детектором для целей судебной токсикологии.
Часть 1. Челябинск, 2001. 62 c.
[10]
Maurer H.H.
// J. Chromatogr.
1992. V.580. N.1-2. P.3-41.
Приложение.
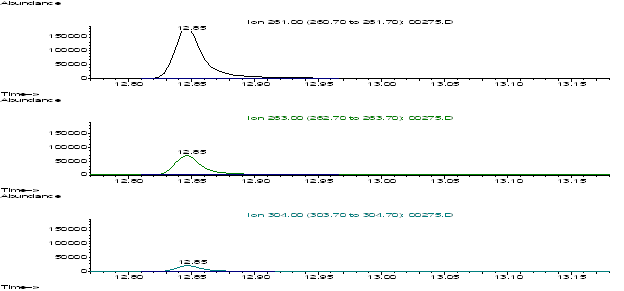
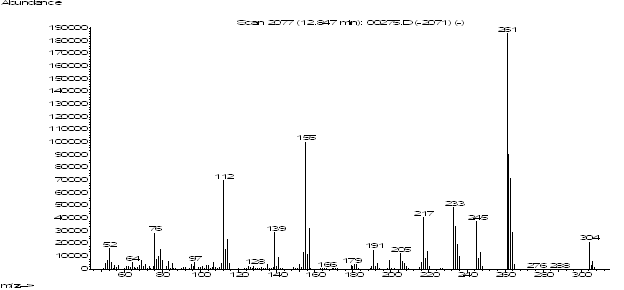
Ионный профиль и масс-спектр ацетилированного 6-(5-хлор-2-пиридил)-7-гидрокси-6,7-дигидро-5Н-пиррол[3,4-b]пиразин-5-она.
Катаев Сергей
E-mail: forenschemist@narod.ru