Журнал
“Судебно-медицинская экспертиза”, 2006, №1, С.20-24.
С.С.
Катаев, Н.Б. Зеленина, Д.Б. Оборин, Т.Л. Малкова
ПРИМЕНЕНИЕ
МЕТОДА ФЛЮОРЕСЦЕНТНО-ПОЛЯРИЗАЦИОННОГО ИММУНОАНАЛИЗА ДЛЯ ВЫЯВЛЕНИЯ ОПИАТОВ В КРОВИ
Пермское областное бюро судебно-медицинской экспертизы
(нач. В.И. Перминов);
Пермская
государственная фармацевтическая академия (ректор, проф. Г.И. Олешко)
Резюме
Показана возможность использования метода флюоресцентно-поляризационного иммуноанализа
(ФПИА) в скрининге наркотических средств группы опия в крови и сыворотке крови как
предварительного метода исследования. Проведено сравнение результатов
исследования образцов крови и сыворотки крови, полученных методами ФПИА и хромато-масс-спектрометрии.
В качестве критерия оценки результата предварительного
исследования предложено использовать точку отсечки путем ввода в серию
анализируемых образцов пробы крови с пороговой концентрацией морфина: для
образцов живых лиц - 20 нг/мл, от трупов - 40 нг/мл. Предложенный метод скрининга опиатов в крови
характеризуется простым и быстрым исполнением, высокой специфичностью и
точностью, экономичным расходованием экспертного материала.
Ключевые слова: опиаты, кровь, флюоресцентно-поляризационный иммуноанализ,
хромато-масс-спектрометрия.
Учитывая сложившуюся ситуацию в области наркотизации населения, одним из важных моментов судебно-химического исследования становится определение в биологическом материале наркотических веществ. Исследование мочи, как это принято в отношении живых лиц в практике химико-токсикологических лабораторий, позволяет судить лишь о самом факте употребления наркотических веществ. Только исследование крови может дать основание для выводов о возможной причине отравления или смерти, как следствия употребления названных веществ.
В практике Пермского областного бюро судебно-медицинской экспертизы примерно 50% направлений для исследования на наркотические вещества включают в качестве объекта исследования только кровь. 34% направлений трупного материала только кровь и органы. 60% направлений от живых лиц составляет только кровь объемом от 3 до 15 мл. Таким образом, имеется объективная необходимость в методах, позволяющих с высокой достоверностью и минимальным расходом экспертного материала проводить предварительный анализ на наличие наркотических веществ в крови.
Предварительное исследование для отсеивания проб, не содержащих определяемых веществ, является одним из важных этапов анализа наркотических веществ в биологическом материале. Для анализа мочи существует широкий круг коммерческих методов иммуноанализа (иммунохроматографический анализ, иммуноферментный анализ, флюоресцентно-поляризационный иммуноанализ - ФПИА) и исследований в тонком слое сорбента (лаборатория TOXI-LAB), позволяющих эффективно решать данную задачу. Для крови таких методов значительно меньше. В последние годы для анализа наркотических веществ в крови и сыворотке крови все более широкое применение находят иммунные методы [6-11].
Целью работы явилось изучение возможности применения метода ФПИА для выявления опиатов в крови и сыворотке от живых лиц и трупов, в качестве предварительного метода исследования.
оборудование и Материалы
Флюоресцентно-поляризационный иммуноанализатор TDxFLx ("Abbott", США). Полуавтоматические пипетки-дозаторы со сменными наконечниками, позволяющие отбирать объемы жидкостей 4-40, 40-200, 200-1000 мкл и 1-5 мл. Калибраторы, контроли и наборы реагентов "Opiates U" для флюоресцентно-поляризационного анализатора TDxFLx. Газовый хроматограф НР5890А серии II с капиллярной кварцевой колонкой НР-5MS 30 м х 0,25 мм и масс-селективным детектором НР5972А (“Hewlett-Packard”, США). Ультразвуковая ванна УЗМ 002 "Серьга". Все используемые растворители и реактивы градации х. ч. Морфина гидрохлорид (ФС 413, ГФ X), кодеин основание (ФС 170, ГФ X), этилморфина гидрохлорид (ФС 41, ГФ X).
Материалы
и методы исследования
Изучали образцы крови и мочи, направленные для исследования на наркотические и лекарственные вещества, забранные от живых лиц и от трупов. Образцы до исследования хранили при температуре 2 – 4оС.
Исследование методом ФПИА. Анализ на анализаторе TDxFLx проводили следующим образом: 100 мкл калибратора, контроля или 200 мкл пробы автоматической пипеткой вносили в лунки для образцов пластмассовых картриджей. Последние вместе со стеклянными кюветами устанавливали во внешнее кольцо измерительной карусели. Подготовленную таким образом карусель устанавливали на шпиндель внутренней части прибора. В отведенные места анализатора помещали буфер и соответствующий набор реагентов.
ФПИА исследование крови и сыворотки проводили по общей схеме: к 1 мл крови или сыворотки добавляли 1 мл ацетона, встряхивали и в течение 5 мин обрабатывали в ультразвуковой ванне. Затем пробы центрифугировали в закрытых флаконах 10 минут при 2000 об/мин. После этого отбирали 200 мкл центрифугата, помещали в катридж анализатора TDxFLx и исследовали на наличие опиатов с применением набора реагентов для анализа мочи "Opiates U".
Результаты исследований, обработанные анализатором TDxFLx, выдавались в виде протокола, в котором отражался номер пробы, концентрация (нг/мл) и интенсивность поляризации (NET P).
Исследование крови методом хромато-масс-спектрометрии (ХМС). Количественное определение общего морфина и кодеина в крови проводили методом ХМС после кислотного гидролиза. Использовали предложенные ранее внутренний стандарт и экстрагент [4].
Во флакон помещали 2,5 мл крови (точно), прибавляли 20 мкл раствора внутреннего стандарта (спиртовой раствор этилморфина гидрохлорида - 0,02 мг/мл), добавляли 2,5 мл дистиллированной воды, взбалтывали, вносили 1 мл концентрированной соляной кислоты и перемешивали. Флакон плотно укупоривали и помещали в кипящую водяную баню на 20 мин. После охлаждения флакон вскрывали, гидролизат фильтровали через бумажный фильтр, флакон и фильтр с остатком замывали 1 мл 0,1 н. раствором соляной кислоты. К фильтрату прибавляли 5 мл хлороформа, экстрагировали 10 минут на встряхивателе, после чего органическую фазу отбирали и отбрасывали (очистка). К водной фазе прибавляли 25% водный раствор аммиака до рН 9-10 и дважды экстрагировали смесью хлороформ – н-бутанол (6:1) порциями по 5 мл каждая. Органические экстракты отделяли, фильтровали через смоченный хлороформом бумажный фильтр с безводным сульфатом натрия в стеклянный флакон. Экстракт выпаривали до сухого остатка в токе теплого воздуха (40-50оС). К сухому остатку прибавляли 40 мкл безводного пиридина и 60 мкл уксусного ангидрида (замывая стенки флакона), флакон плотно укупоривали и выдерживали 20 минут при 80оС. После охлаждения флакон вскрывали и выпаривали избыток реагентов в токе теплого воздуха (40-50оС). Сухой остаток растворяли в 100 мкл безводного этилацетата и 2 мкл вводили в инжектор ХМС.
Калибровочный график зависимости концентрации к площади внутреннего стандарта (400 нг этилморфина гидрохлорида) строили путем добавления к 10 мл крови спиртовых растворов морфина гидрохлорида и кодеина основания для получения концентраций: 10; 100; 1000 нг на 1 мл крови. Проводили по три определения для каждой калибровочной точки с использованием 2,5 мл крови и методики пробоподготовки, аналогичной вышеизложенной. Количественное определение проводили с использованием ПЭВМ и программного обеспечения ChemStation G1034C. Перерасчет концентрации (Сх) морфина и кодеина в крови проводили по формуле:
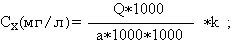
где: Q – количество вещества, определенное по графику (нг); а - количество крови, взятой для исследования (мл); k - коэффициент пересчета (для морфина k=0,76, для кодеина k=0,94).
В заключение эксперта выносится среднее значение концентрации общего морфина или кодеина в мг/л, определенное при исследовании двух проб образца. Далее по тексту для удобства мы будем использовать количественные показатели (в нг/мл).
Интерпретация результатов исследования крови. Положительный результат фиксировали при идентификации пиков со временем удерживания ацетильных производных морфина и/или кодеина, при соответствии соотношения ионов в интервале ± 20%.
ХМС - исследование мочи. К 2 мл мочи прибавляли 0,4 мл концентрированной соляной кислоты, флакон плотно закрывали и выдерживали 20 минут на кипящей водяной бане. После охлаждения к гидролизату прибавляли 25% водный раствор аммиака до рН 9-10 и дважды экстрагировали смесью хлороформ – н-бутанол (6:1) порциями по 2 мл. Органические фазы отделяли, объединяли и фильтровали через бумажный фильтр с безводным сульфатом натрия. Фильтрат выпаривали досуха в токе теплого воздуха (40-50оС). К сухому остатку прибавляли 40 мкл безводного пиридина и 60 мкл уксусного ангидрида. Флакон герметично укупоривали и нагревали в термоблоке 20 минут при 80оС. После охлаждения флакон вскрывали и выпаривали избыток реагентов досуха. Сухой остаток растворяли в 100-200 мкл безводного этилацетата и 1-2 мкл вводили в инжектор хроматографа.
Интерпретация результатов исследования мочи. Положительный результат фиксировали при наличии на хроматограмме пиков веществ, соответствующих по времени удерживания и масс-спектру ацетилированным производным морфина и/или кодеина.
Условия ХМС - исследования. Колонка НР-5MS, 30 м х 0,25 мм, скорость газа носителя (гелий) - 1,5 мл/мин, режим работы split/splitless (деление потока 1:10, с задержкой включения 1 мин после ввода пробы), температура инжектора 250оС, интерфейса детектора 280оС, температура колонки программируемая. Начальная температура 70оС в течение 2 мин, затем прогрев 20 оС/мин до 270оС с выдержкой 3 мин, далее прогрев до 290оС и выдержкой в течение 5 мин для удаления балластных компонентов пробы.
Режим работы МСД при анализе крови: селективный ионный мониторинг в интервале 13-15 минут (см. табл. 1), напряжение на умножителе устанавливается на 350 В выше величины стандартной автоматической настройки детектора. Пороговая концентрация морфина и кодеина для крови - 10 нг/мл. Коэффициент корреляции для кодеина – 0,994, для морфина – 0,983.
Таблица 1.
Хромато-масс-спектрометрические данные
для анализа опиатов в крови.
|
Соединение |
m/z и интенсивности ионов |
Интервал сканирования, мин |
Время удерживания, мин |
Индекс удерживания (RI) |
||
|
Ацетилкодеин |
341 |
282 (65) |
229 (35) |
13,30 - 13,65 |
13,57 |
2610 |
|
Ацетилэтилморфин |
355 |
296 (54) |
243 (23) |
13,65 - 14,00 |
13,72 |
2640 |
|
Диацетилморфин |
327 |
369 (73) |
310 (53) |
14,00 - 15,00 |
14,46 |
2732 |
Режим работы МСД при анализе мочи: полное сканирование ионов от 45 до 450 атомных масс. Время удерживания ацетилкодеина 13,57 минуты (RI 2610), диацетилморфина 14,46 минуты (RI 2732). Предел обнаружения для морфина и кодеина не менее 50 нг/мл для каждого, при исследовании 1 мкл образца, растворенного в 100 мкл этилацетата.
Относительную чувствительность, специфичность и точность метода ФПИА рассчитывали по формулам:
Чувствительность = [ИП/(ЛП + ЛО)] х 100,
Специфичность = [ИО/(ИО + ЛП)] x 100,
Точность = [ИП + ИО /( ИП + ИО + ЛП + ЛО)] x 100,
где ИП - количество истинно положительных проб, ИО - количество истинно отрицательных проб, ЛП - количество ложноположительных проб, ЛО - количество ложноотрицательных проб.
Результаты
исследования и их обсуждение
Метод ФПИА позволяет определять опиаты в моче без ее обработки. Кровь требует предварительной подготовки. Высокая специфичность иммунных методов позволяет исследовать пробы с соблюдением минимальных требований. Таким образом, одним из этапов в подготовке к исследованию методом ФПИА образца крови или сыворотки является необходимость осаждения форменных элементов и белков, которые могут повлиять на результаты исследования. Для этой цели в практике широко используют такие органические растворители, как метанол, ацетон и ацетонитрил. Последние два растворителя легко денатурируют и осаждают белки уже в соотношении 1:1, в отличие от метанола, которого необходимо взять в соотношении 1:2 [6]. Это ведет к разбавлению пробы и снижению чувствительности метода при дальнейшем проведении прямого исследования образца.
Ацетон и ацетонитрил имеют высокую экстрагирующую способность, легко проникают через клеточные мембраны и обеспечивают большой выход определяемых веществ из тканей [2, 3]. Однако ацетонитрил, являясь более гидрофильным соединением, хуже растворяет липиды, что приводит к образованию конгломератов (сгустков), вследствие адгезии форменных элементов крови. При добавлении ацетона к крови не происходит образования сгустков, поэтому обеспечивается лучший контакт растворителя с определяемым веществом. Ацетонитрил и метанол, по сравнению с ацетоном, дают при работе с гемолизованной и гнилостноизмененной кровью извлечения с более интенсивной окраской. Исходя из этого, для исследования в качестве осадительного агента был использован ацетон.
Одностадийность выделения веществ с последующим прямым исследованием извлечения является более привлекательной, так как упаривание растворителя с последующим восстановлением пробы ведет к окислению и адсорбции компонентов последней.
Таблица 2.
Калибровочные данные метода ФПИА для опиатов.
|
Концентрация морфина, нг/мл |
Категория стандарта |
Интенсивность поляризации, NET P |
D NET P* |
|
0 |
Калибратор |
210,81 |
- |
|
100 |
Калибратор |
166,66 |
-44,15 |
|
200 |
Калибратор |
131,62 |
-35,04 |
|
250 |
Нижний контроль |
120,75 |
-10,87 |
|
350 |
Калибратор |
107,55 |
-13,2 |
|
600 |
Калибратор |
93,16 |
-14,39 |
|
800 |
Верхний контроль |
87,27 |
-5,89 |
|
1000 |
Калибратор |
85,67 |
-1,6 |
Примечание. *- приращение NET P выражено как разность между настоящей и предыдущей величиной интенсивности поляризации.
В табл. 2 приведены данные калибровки иммуноанализатора и результаты исследования контролей предназначенных для анализа мочи. Как видно из графика на рисунке и табл. 2, приращение интенсивности поляризации (D NET P) в интервале от 0 до 1000 нг/мл не является линейным. При этом наибольшее разрешение наблюдается для низких концентраций. Это позволяет предположить, что разрешение диапазона концентраций от 0 до 100 нг/мл может быть использовано для определения опиатов в концентрациях от 5 до 30 нг/мл, которые рассматриваются как пороговые концентрации в скрининге опиатов с использованием различных методов иммуноанализа в крови [7-9, 11].
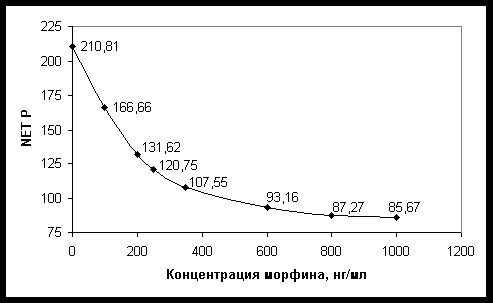
Зависимость интенсивности поляризации
(по оси ординат) от концентрации морфина (по оси абсцисс).
Результаты исследования холостых проб и проб с добавлением стандартного раствора морфина гидрохлорида (в количестве 38 нг/мл в пересчете на основание морфина) приведены в табл. 3.
Таблица 3.
Результаты исследования холостых проб
крови и сыворотки с добавкой морфина.
|
Образец |
Холостая, NET P |
С добавкой |
D NET P |
|
|
NET P |
С, нг/мл |
|||
|
Сыворотка |
212,54 |
196,66 |
40,47 |
-15,88 |
|
Сыворотка |
213,13 |
195,82 |
42,18 |
-17,31 |
|
Кровь |
213,83 |
198,82 |
36,00 |
-15,01 |
|
Сыворотка |
214,60 |
196,05 |
41,71 |
-18,55 |
|
Кровь |
213,98 |
194,54 |
44,75 |
-19,44 |
|
Кровь |
213,82 |
195,70 |
42,43 |
-18,12 |
|
Сыворотка |
212,81 |
193,14 |
47,53 |
-19,67 |
|
Сыворотка |
213,50 |
194,46 |
44,90 |
-19,04 |
|
Кровь |
210,80 |
193,77 |
46,27 |
-17,03 |
|
Сыворотка |
215,78 |
194,82 |
44,19 |
-20,96 |
|
Кровь |
209,81 |
187,11 |
59,27 |
-22,70 |
|
Кровь |
211,16 |
188,94 |
55,73 |
-22,22 |
|
Сыворотка |
212,49 |
187,45 |
58,61 |
-25,04 |
|
Кровь |
213,78 |
195,13 |
43,57 |
-18,65 |
Исследовано 28 проб, из них по 7 образцов крови холостых и с добавкой морфина, а также по 7 образцов сыворотки крови холостых и с добавкой морфина. В табл. 4 приведены интервалы и средние значения концентраций опиатов, а также D NET P, полученные при исследовании образцов холостых и с добавлением морфина. Приведены как суммарные значения для крови и сыворотки крови, так и результаты отдельно для каждого типа объекта. Как видно из табл. 4, полученные результаты средних значений для крови и сыворотки крови являются близкими, что позволяет говорить о возможности использования метода ФПИА для любого из них.
Таблица 4.
Интервалы и средние значения концентраций и приращения интенсивности поляризации (D NET P), полученные при исследовании холостых проб и образцов с добавлением морфина.
|
Образцы |
Интервал значений концентраций, нг/мл |
Среднее значение концентрации, нг/мл |
Интервал значений D NET P |
Среднее значение D NET P |
|
Холостые пробы |
0 ÷ 6,51 |
0,95 ± 2,27 |
|
|
|
Пробы с добавлением стандарта, в том числе: кровь (7 образцов); сыворотка (7 образцов). |
36,0 ÷ 59,27 36,0 ÷ 59,27 40,47 ÷ 58,61 |
46,26 ± 6,90 (15%) 46,86 ± 8,02 (17%) 45,66 ± 6,17 (14%) |
-15,01 ÷ -25,04 -15,01 ÷ -22,70 -15,88 ÷ -25,04 |
-19,26 ± 2,74 (14%) -19,02 ± 2,74 (14%) -19,49 ± 2,94 (15%) |
Если рассматривать диапазон концентраций от 0 до 100 нг/мл, то на единицу D NET P приходится 2,27 нг/мл морфина в калибровочном образце (см. табл. 2), та же средняя величина для образцов крови и сыворотки составила 1,97 (см. табл. 4). Эти результаты показывают, что в интервале значений концентраций до 100 нг/мл метод имеет зависимость значения NET P от концентрации морфина близкую к линейной. Таким образом, метод ФПИА объективно позволяет проводить исследование образцов крови и сыворотки, содержащие опиаты и, в частности, морфин как основное производное и метаболит большинства наркотических средств группы опия в рассматриваемом диапазоне.
Учитывая, что метод ФПИА применяется как предварительный для скрининга опиатов, не имеет смысла построения калибровочного графика зависимости NET P от концентрации морфина в крови и/или сыворотке крови, как предлагалось [11]. Более эффективным будет применение точки отсечки путем ввода пробы со значением пороговой концентрации морфина. Такую пробу можно приготовить с использованием интактного образца и калибраторов к анализатору, либо раствора стандарта и исследовать с каждой серией анализируемых проб аналогично контролю. Таким образом, пороговое значение метода ФПИА при исследовании крови определяли путем введения в серию образцов пробы крови с пороговой концентрацией морфина. Исследовали кровь от живых лиц с концентрацией основания морфина 20 нг/мл, для трупов с концентрацией 40 нг/мл. Образцы в серии проб, для которых полученные концентрации были ниже указанных, рассматривали как отрицательные.
При исследовании трупного материала в качестве пороговой концентрации для опиатов в методе ФПИА использовали двукратную величину (40 нг/мл), примененную для живых лиц. Эта величина позволяет исключить ложноположительные результаты при исследовании образцов с гнилостными изменениями. В подобных случаях в отношении некоторых образцов крови, не содержащих опиаты, могут быть получены результаты до 35 нг/мл.
Для сравнения использовали результаты ХМС-исследования. В общее исследование вошло 160 образцов крови и сыворотки крови, из них 99 - от живых лиц и 61 - от трупов. По 40 образцов от трупов и живых лиц были представлены с мочой.
В табл. 5 приведены сравнительные результаты, полученные методами ФПИА и ХМС, а также структура данных по образцам от живых лиц и трупов.
Таблица 5.
Результаты исследования крови и сыворотки крови от живых лиц и трупов методом ФПИА, подтвержденные методом ХМС.
|
Пробы |
Всего образцов |
От живых лиц |
От трупов |
|
С положительным результатом |
58 |
29 |
29 |
|
С отрицательным результатом |
102 |
70 |
32 |
|
Всего |
160 |
99 |
61 |
Из 160 исследованных образцов положительный результат получен в отношении 58 проб крови и сыворотки. Для них методом ХМС было подтверждено наличие морфина и/или кодеина. Это позволяет говорить о 100%-ной чувствительности, специфичности и точности метода ФПИА (при заданных пороговых концентрациях не было получено ложноположительных и ложноотрицательных результатов).
Хорошо согласованными оказались результаты исследования крови или сыворотки в совокупности с мочой, в парах отрицательных и положительных образцов от трупов и живых лиц. В случаях, когда один из образцов в паре давал положительный результат, наблюдалось резкое различие для пар образцов от трупов и живых лиц.
В отношении образцов крови и мочи от живых лиц наблюдается ситуация, когда в моче обнаружен морфин, а в крови или сыворотке он не определяется, что характерно для конечной стадии элиминации. Для пар проб от трупов встречается противоположная ситуация – наличие высоких концентраций морфина в крови и отсутствие или низкие концентрации (иногда ниже пороговой концентрации для метода ФПИА – 200 нг/мл), что характерно для случаев “быстрой” смерти у потребителей героина [1]. В 18 из 40 пар образцов от трупов опиаты не найдены, в 20 парах найдены в обоих объектах, причем в 4 образцах мочи методом ФПИА получены концентрации от 39,5 до 86,5 нг/мл, а методом ХМС в них был найден морфин в следовых количествах. В 2 парах образцов в моче обоими методами опиаты не были найдены, при наличии морфина в крови. Полученные результаты свидетельствуют о необходимости проведения исследования двух объектов, один из которых позволяет оценивать текущее состояние (кровь, сыворотка), а второй контролировать стадию элиминации (моча - от живых лиц, моча, желчь - от трупов). Также показаны необходимость осторожного использования метода иммуно-хроматографического анализа образцов мочи от трупов для определения наркотических веществ [5] и первостепенная важность лабораторного исследования образцов крови.
В табл. 6 приведены обобщенные количественные результаты для образцов крови и сыворотки, полученные методами ФПИА (по калибровочной кривой со стандартными калибраторами для анализа мочи) и ХМС от живых лиц и от трупов (не включены образцы, превысившие по результатам ФПИА исследования концентрации 1000 нг/мл).
Таблица 6.
Количественные результаты методов ФПИА и ХМС (в нг/мл).
|
Пробы |
ФПИА |
ХМС |
||
|
Интервал |
Среднее значение |
Интервал |
Среднее значение |
|
|
взятые от живых лиц |
29,3 ¸ 751,0 |
159,5 ± 185,9 |
33 ¸ 2050 |
341 ± 489 |
|
взятые от трупов |
60,7 ¸ 822,8 |
275,7 ± 193,8 |
187 ¸ 5440 |
1047 ± 1305 |
Метод ФПИА позволяет проводить полуколичественную оценку содержания суммы опиатов в объекте. Сравнение количественных результатов, полученных методами ФПИА и ХМС, показало, что для образцов крови (сыворотки) от живых лиц метод ФПИА дает занижение количества опиатов в среднем на 53%, а для трупного материала – на 74%. Данное различие в количественных результатах наблюдается в основном при значительных концентрациях опиатов в крови, т. е. в диапазоне, где метод ФПИА имеет низкое разрешение. Частично данное расхождение можно так же отнести к различной реактивности метода ФПИА к морфину, производным морфина, их метаболитам (диацетилморфину, 6-ацетилморфину, норморфину, кодеину, норкодеину) и ряду их производных с глюкоуроновой кислотой [12].
Выводы
- Предложен вариант простого, быстрого и эффективного скрининга опиатов в крови или сыворотке крови от живых лиц и трупов с применением метода ФПИА.
- Проведено сравнение результатов исследования образцов крови и сыворотки, полученных методами ФПИА и ХМС.
- Показана возможность использования метода ФПИА, как предварительного метода исследования в химико-токсикологическом и судебно-химическом анализе опиатов в крови и сыворотке.
- Предложенный метод скрининга опиатов характеризуется высокой специфичностью, точностью и чувствительностью.
Литература
- Веселовская Н.В., Коваленко А.Е. Наркотики. – М.:"Триада-Х", 2000.– 206 с.
- Карташов В.А. Изучение вопросов экстракции лекарственных веществ из биологического материала: Автореф. дис. … д-ра фарм. Наук. – Барнаул, 1990. – 43 c.
- Кушнирева О.Н. Использование комплекса хроматографических и иммунохимических методов в химико-токсикологическом анализе ряда производных 1,4-бензодиазепина, дифенилметана, фенитиазина и тропановых алкалоидов: Автореф. дис. … канд. фарм. наук. – Пермь, 2003. – 21 c.
- Мелентьев А.Б. Практическое руководство по скринингу лекарственных, наркотических веществ и их метаболитов методом газовой хроматографии с масс-селектвным детектором для целей судебной токсикологии. Челябинск, 2001.– Часть 1. – 62 c.
- Шигеев В.Б., Шигеев С.В. // Судебно-медицинская экспертиза отравлений наркотическими веществами, психотропными средствами и алкоголем. Сб. научных трудов по материалам Всероссийского совещания судебно-медицинских экспертов, наркологов и криминалистов с участием представителей правоохранительных органов. – Казань, 2001. – C.33-37.
- Asselin W.M., Leslie J.M., McKenley B. // J. Analyt. Toxicol. – 1988. – Vol.12. – P.207-215.
- Collison I.B., Spiehler V.R., Guluzian S., Sedgwick P.R. // J. Forens. Sci.– 1998. – Vol.43. – N.2. – P. 390–394.
- Kаferstein H., Sticht G. // Rechtsmedizin.
– 1998. – Bd. 8. – S.173–177.
- Kerrigan S., Phillips W.H.Jr. // Clinical Chemistry. –
2001. – Vol.47. – N.3. – P.540–547.
- Lewellen L.J., McCurdy H.H. // J. Analyt. Toxicol. – 1988. – Vol.12. – P.260-264.
- Toennes S. W., Kauert G. // Rechtsmedizin.
– 2000. – Bd.10.
- S.71–75.
- TDx/TDxFLx OPIATES.- Abbott Laboratories Diagnostics Division.- List No. 9673.- 2001.
Катаев Сергей Сергеевич
E-mail: forenschemist@narod.ru