Журнал “Судебно-медицинская экспертиза”, 2010,
№6, С.35-38.
С.С. Катаев, Е.А. Крылова
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СТРИХНИНА В КРОВИ И МОЧЕ МЕТОДОМ ГАЗОВОЙ
ХРОМАТОГРАФИИ С МАСС-СЕЛЕКТИВНЫМ ДЕТЕКТОРОМ
ГУЗОТ «Пермское краевое бюро
судебно-медицинской экспертизы» (нач. – В.И. Перминов), Пермь
Резюме
Предложена методика
количественного определения стрихнина в крови и моче методом газовой
хроматографии – масс-спектрометрии. Пробоподготовка предусматривает извлечение
стрихнина с применением патронов для твердофазной экстракции AccuBond EVIDEX со смешанной фазой (катионит и
октадецил- привитая фаза) и дисков SPEC
MP3 со свойствами катионита и слабо полярной фазы.
Эффективность экстракции наблюдалась высокой и составила: для крови – 92,5 %,
для мочи – 89,7 %. В качестве внутреннего стандарта применен папаверин. Предел
обнаружения стрихнина в крови составил 0,05 мг/л, в моче – 0,02 мг/л. Предел
количественного определения в крови – 0,10 мг/л; в моче – 0,05 мг/л.
Ключевые
слова: стрихнин,
газовая хроматография – масс-спектрометрия, твердофазная экстракция.
Яды широко распространены
в окружающей природе у растений и животных, человечество издавна применяло их
для своих потребностей как лекарства, для охоты, рыбалки, в качестве дополнения
к оружию, в военных и преступных целях. Одним из таких ядов является стрихнин [10].
Стрихнин – (стрихнидин–10–он) алкалоид, содержащийся во многих видах
чилибухи (Strychnos) произрастающей в тропиках Азии и
Африки. Сырьём для его
получения являются семена Strychnos Nux Vomica. Стрихнин обладает
выраженным нейротоксическим действием, являясь высокоселективным конкурентным
антагонистом глицина, а также других тормозных аминокислот – β-аланина и
таурина. При этом увеличивается преимущественно рефлекторная активность
спинного мозга, что при приеме токсических доз проявляется болезненным судорожным
синдромом, сопровождающимся психическим возбуждением и явным чувством страха.
В
наши дни для медикаментозных целей применяется стрихнина нитрат в гомеопатии в
форме Nux Vomica D4-D6 при
лечении дистонических состояний. Кроме того, до сих пор он используется для
приготовления приманок, где данное вещество выступает в роли весьма
эффективного смертельного яда для уничтожения волков. В Европе же препараты из
рвотных орехов используют и в настоящее время для борьбы с грызунами [1]. Тем
не менее, случаи отравлений людей стрихнином со смертельным исходом можно назвать казуистическими, т.к. отмечались довольно редко за
последние 25 лет [5, 6, 8, 9, 11]. В
России данное вещество трудно назвать доступным для широких слоев населения; стрихнина
нитрат во всех его лекарственных формах и дозировках относится к ядовитым
веществам [2].
Для выделения стрихнина
из биологического материала применяются жидкость-жидкостная экстракция [6, 8], твёрдофазная экстракция [4] и твёрдофазная микроэкстракция [3]. Для количественной оценки
содержания стрихнина в биологических объектах используются методы газовой
хроматографии с масс-спектрометрией [3, 4, 8] и
жидкостной хроматографии с диодно-матричным детектором [6] или масс-селективным детектором [7].
В нашей практике
наблюдался случай смертельного отравления стрихнином. Для оценки концентрации данного яда в
биоматериале нами был разработан метод количественного определения
стрихнина в крови и моче с использованием твёрдофазной экстракции (ТФЭ) и газовой
хроматографии с масс-селективным детектором (ГХ-МС).
Оборудование и материалы
Оборудование. Газовый
хроматограф Agilent 6850, масс-селективный детектор Agilent 5973N (Agilent, США), колонка капиллярная НР-5MS, внутренний диаметр
Материалы. Все
используемые растворители реактивы градации «х.ч.». Стрихнина нитрат (ст. 639, ГФ
X), папаверина
гидрохлорид (ст. 503, ГФ X). Картриджи с дисками для ТФЭ SPEC MP3 (30 мг/ 10 мл) и патроны для ТФЭ AccuBond EVIDEX (200 мг/3 мл). Пробы крови и мочи до
исследования хранились при + 4оС.
Методики исследования
Выделение срихнина
из крови. В стеклянный флакон объемом на 10 мл вносили 1 мл крови, прибавляли 25
мкл раствора внутреннего стандарта (спиртовой раствор папаверина гидрохлорида –
0,02 мг/мл), 4 мл 1/15 М буфера фосфатного (рН 6,0). Флакон плотно укупоривали
и помещали в ультразвуковую ванну на 10 минут, содержимое флаконов центрифугировали
при 3000 об/мин в течение 5 минут, центрифугат отделяли от осадка. Экстракцию
проводили на патронах для ТФЭ AccuBond EVIDEX (200 мг/3 мл) Протокол
ТФЭ представлен в таблице 1.
Таблица 1
Протокол твердофазной экстракции на патронах AccuBond II
EVIDEX
|
Этап |
ТФЭ на
патронах AccuBond II EVIDEX |
|
Кондиционирование |
2 мл этанола; 2 мл 1/15М буфера
фосфатного рН 6,0; |
|
Загрузка
образца |
со скоростью 1 мл/мин |
|
Промывка |
2 мл 1/15М буфера фосфатного рН 6,0; 2 мл 0,1М кислоты уксусной; 2 мл 10% раствора этанола в воде |
|
Элюирование |
2 х 1 мл элюента гексан–этилацетат
(3:1); 2 мл метанола; 2 х 1 мл дихлорметан–пропанол-2–25%
аммиак (4:1:0,1) |
Кондиционирование
сорбента проводили путем последовательного пропускания через картридж 2 мл 95%
этанола и 2 мл 1/15 М фосфатного буфера рН 6,0. Далее загружали образец со
скоростью 1 мл/мин. Промывку осуществляли последовательно: 2 мл 1/15 М
фосфатного буфера рН 6,0, 2 мл 0,1 М раствора уксусной
кислоты и 2 мл 10% раствора этанола. Патрон сушили под вакуумом в течение 5
минут. Очистку производили первоначально двукратным пропусканием через сорбент
1 мл смеси н-гексан–этилацетат (3:1) и далее 2 мл метанола. Элюировали дважды
по 1 мл смеси дихлорметан–пропанол-2–25% раствор аммиака (4:1:0,1), элюаты
испаряли в токе азота при 60оС.
Выделение срихнина
из мочи. В стеклянный флакон объемом на 10 мл вносили по 2 мл мочи, прибавляли
по 50 мкл раствора внутреннего стандарта (спиртовой раствор папаверина
гидрохлорида – 0,02 мг/мл), по 1 мл 1/15 М фосфатного буфера рН 6,0. Экстракция
проводилась на дисках для ТФЭ SPEC MP3 (30 мг/ 10 мл) Протокол
ТФЭ представлен в таблице 2.
Таблица 2
Протокол твердофазной экстракции на дисках SPEC МР3
|
Этап |
ТФЭ на
дисках SPEC МР3 |
|
Кондиционирование |
0,5 мл этанола; 0,5мл 1/15М буфера фосфатного рН
6,0; |
|
Загрузка
образца |
со скоростью 1 мл/мин |
|
Промывка |
0,2 мл 1/15М буфера фосфатного рН
6,0; 0,2 мл
воды дистиллированной |
|
Элюирование |
2 х 0,5 мл дихлорметан–пропанол-2–25%
аммиак (4:1:0,1) |
Кондиционирование
сорбента проводили путем последовательного пропускания через картридж 0,5 мл
95% этанола и 0,5 мл 1/15 М фосфатного буфера рН 6,0. Далее загружали образец
со скоростью 1 мл/мин. Промывку осуществляли последовательно: 0,2 мл 1/15 М
фосфатного буфера рН 6,0 и 0,2 мл воды дистиллированной. Патрон с диском SPEC MP3 высушивали путем
центрифугирования при 2000 об/мин в течение 5 минут и последующим выдерживанием
под вакуумом в течение 5 мин. Элюировали дважды по 0,5 мл смеси
дихлорметан–пропанол-2–25% раствор аммиака (4:1:0,1), элюаты испаряли в токе
азота при 60оС.
Исследование ГХ-МС. Сухие остатки
растворяли в 200 мкл метанола, перемешивали на микровстряхивателе в течение 30
сек и 1 мкл раствора вводили в испаритель хромато-масс-спектрометра с
использованием устройства
автоматического ввода проб. Режим ввода пробы: пять промывок этанолом;
пять промывок этилацетатом; одна промывка шприца пробой; три прокачки пробой
перед вводом; набор и ввод пробы; пять промывок этанолом; пять промывок
этилацетатом.
Ввод пробы в режиме split/splitless (задержка включения деления потока
газа-носителя после ввода пробы 0,8 мин). Скорость потока газа носителя (гелий)
через колонку 1,5 мл/мин. Температура испарителя и интерфейса детектора 270о
и 280оС, температура колонки программируемая, начальная
температура 150оС в течение 1 мин, затем прогрев до 270оС
со скоростью программирования 30 градусов в минуту, далее до 300оС
со скоростью программирования 10 градусов в минуту. Режим работы детектора:
селективный ионный мониторинг (таблица
3).
Таблица 3
Характеристические ионы, времена
удерживания и интервалы регистрации ионов для определяемых соединений
|
Соединение |
Характеристические ионы, m/z (интенсивность, %) |
Время удерживания, мин |
Интервал регистрации ионов, мин |
||
|
Стрихнин |
334 (100) |
335 (24,10) |
319 (6,40) |
10.85 |
10.00 – 12.00 |
|
Папаверин* |
338 (100) |
324 (92,60) |
339 (78,60) |
8.30 |
8.00 – 10.00 |
*Внутренний стандарт
Построение градуировочных графиков проводили методом
внутреннего стандарта. Графики зависимости концентрации по отношению площади
пика иона с величиной m/z 334 стрихнина к площади пика иона с величиной m/z 338 внутреннего стандарта (папаверина
гидрохлорида в количестве 500 нг для
образцов крови и 1000 нг для образцов мочи) строили для проб с
добавлением спиртовых растворов стрихнина нитрата (в пересчете на основание)
для получения концентраций в крови: 50, 100, 250, 500, 2500, 5000 и 10000 нг/мл
и в моче: 50 нг/мл, 250 нг/мл, 500
нг/мл, 2500 нг/мл и 5000 нг/мл. Проводили по два определения для каждой
калибровочной точки с использованием методики
пробоподготовки аналогичной выше изложенной. Количественное определение
проводили с использованием ПЭВМ и программного обеспечения G1701DA MSD ChemStation. Расчет концентрации стрихнина проводили по формуле:
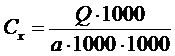 , где Сx – концентрация стрихнина в
объекте, мг/л; Q – количество стрихнина, полученное по графику, нг; а – объем крови
(мочи), взятый на исследование, мл.
, где Сx – концентрация стрихнина в
объекте, мг/л; Q – количество стрихнина, полученное по графику, нг; а – объем крови
(мочи), взятый на исследование, мл.
Полученные для крови и мочи градуировочные графики являются
линейными в диапазоне концентраций 0,05 – 10,0 мг/л и 0,05 – 5,0 мг/л
соответственно. Коэффициент корреляции графика по крови составил r2=0,994, для мочи – r2=0,992.
Прецизионность метода оценивали по результатам
исследования «холостых» проб биологического материала с добавкой известного
количества стрихнина (табл. 4).
Таблица 4
Оценка прецизионности результатов
измерения для контрольных проб крови и мочи с добавкой стрихнина (Р=0,95; n=3)
|
Показатель |
Кровь с добавкой стрихнина, мг/л |
Моча с добавкой стрихнина, мг/л |
||
|
0,10 |
10,0 |
0,25 |
2,5 |
|
|
Стандартное отклонение
повторяемости (σr) |
± 0,02 |
± 0,40 |
± 0,01 |
± 0,16 |
|
Относительное стандартное
отклонение, % (S) |
± 15,9 |
± 5,1 |
± 6,0 |
± 8,3 |
Результаты
исследований и их обсуждение
В
мае 2009 г на
судебно-химическое исследование был доставлен биологический материал от трупа
П. мужского пола, 35 лет
с целью определения алкоголя, технических жидкостей, гликолей, наркотических и лекарственных веществ. По
обстоятельствам дела гражданин П., со слов родственников, до смерти высказывал мысли, имевшие суицидальный характер. При внешнем осмотре трупа П. в полости рта
находилась жидкость синего цвета, на секции каких-либо значимых изменений
обнаружено не было. В биологических объектах был обнаружен
алкоголь, концентрация этанола в крови составила 3,2 г/л, в моче – 3,6 г/л. Судебно-химическое
исследование не выявило летучих растворителей и гликолей, а так же
наркотических веществ. При проведении
предварительных исследований на наркотические и лекарственные вещества
использовался классический метод извлечения из органов по Васильевой с
последующим хроматографическим скринингом в тонком слое сорбента и дальнейшим
ГХ-МС анализом. В результате проведенных
аналитических действий во всех исследованных биообъектах (кровь, моча, печень,
желудок) был обнаружен и идентифицирован стрихнин. В ходе исследований нами была
отмечена интересная особенность, дополняющая клиническую и секционную картину
отравления стрихнином, а также объясняющую наличие синей жидкости в ротовой
полости трупа. Выявлено, что соэкстрактивным соединением, при выделении
стрихнина, являлся краситель синего цвета основного характера (метиленова
синь). Известно, что метиленова синь является красителем, часто применяемым в
технологии приготовления пилюль для уничтожения волков. Краситель даёт возможность охотнику понять,
какие волки отравлены, если приходила стая, и разыскать потом отравленного
зверя по следу, так как окрашенная слюна делает заметным след отравленного
волка.
Для количественной оценки
содержания стрихнина в крови и моче нами был выбран метод ТФЭ, как более простой
и быстрый вариант пробоподготовки. В качестве патронов использовали AccuBond EVIDEX со смешанной фазой (катионит и
октадецил- привитая фаза) и диски SPEC
MP3 со свойствами
катионита и слабо полярной фазы. Данный тип сорбентов позволяет выполнить
высокоселективное выделение стрихнина из биологических объектов, что не
реализуется в полной мере для полимерных фаз на основе сополимеров стирола и
дивинилбензола [4]. Литературные
данные свидетельствуют о хороших результатах извлечения стрихнина как методом
ТФЭ с выходом от 88 до 94 % [4], так и с применением ЖЖЭ, имеющей выход от 78 до 99 % [8]. Во всех случаях в качестве внутреннего стандарта для
количественного определения стрихнина был использован папаверин [3,
4, 8], который отвечает
всем требованиям внутреннего стандарта, обладая близкими стрихнину
физико-химическими свойствами (константа диссоциации, липофильность, близкие
значения величин m/z и интенсивности молекулекулярных ион-радикалов в масс-спектрах).
Изучение эффективности экстракции
стрихнина и папаверина из крови на патронах AccuBond EVIDEX показало высокий выход от 86,1 до
117,2 % для целевого соединения и от 84,1 до 101,2 % для папаверина (табл. 5). Предел
обнаружения стрихнина в крови составил 0,05 мг/л, предел количественного
определения 0,10 мг/л.
Таблица 5
Эффективность экстракции стрихнина и
папаверина из крови на патронах AccuBond EVIDEX
|
Компонент |
Концентрация, нг/мл |
Проба 1 |
Проба 2 |
Проба 3 |
|
S, % |
|
стрихнин |
100 |
87,9 |
86,9 |
117,2 |
97,3 ± 17,2 |
17,7 |
|
10000 |
90,5 |
86,1 |
86,3 |
87,6 ± 2,5 |
2,8 |
|
|
папаверин |
500 |
101,2 |
84,8 |
99,4 |
95,1 ± 9,0 |
9,5 |
Применение дисков для ТФЭ
SPEC MP3 так же дали высокие результаты
эффективности экстракции стрихнина и папаверина из мочи (табл. 6). Выход
стрихнина находился в интервале 88,6 –
92,7 %, при этом относительное стандартное отклонение не превышало 2,6%. Предел
обнаружения стрихнина в моче составил 0,02 мг/л, предел количественного
определения – 0,05 мг/л.
Таблица 6
Эффективность экстракции стрихнина и
папаверина из мочи на дисках SPEC MP3
|
Компонент |
Концентрация, нг/мл |
Проба 1 |
Проба 2 |
Проба 3 |
|
S, % |
|
стрихнин |
250 |
92,7 |
92,7 |
88,6 |
91,3 ± 2,4 |
2,6 |
|
2500 |
86,5 |
90,4 |
87,0 |
88,0 ± 2,2 |
2,5 |
|
|
папаверин |
500 |
92,2 |
91,3 |
99,5 |
94,4 ± 4,5 |
4,8 |
В
результате исследования экспертного материала от трупа П. по выше описанной
методике были получены следующие результаты: концентрация стрихнина в крови
составила – 6,25, в моче – 0,58
мг/л. Согласно литературе, токсические
концентрации стрихнина в сыворотке крови составляют 0,075-0,1 мг/л, смертельные
– более 0,2 мг/л [12].
Выводы
1.
Разработаны методы количественного
определения стрихнина в цельной крови и моче с использованием современных
методов аналитической химии, какими являются твердофазная экстракция и газовая
хроматография – масс-спектрометрия.
2.
Данный метод извлечения стрихнина отличается высокой
селективностью, за счет применения твердофазной
экстракции на сорбентах со смешанной фазой, а также имеет высокую
эффективность экстракции для крови (92,5 %) и для мочи (89,7 %).
3.
Описанный метод реализован на
экспертном материале для подтверждения и количественного определения стрихнина
в крови и моче, и может быть применен
при проведении химико-токсикологических и судебно-химических исследований.
Литература
1. Куценко С.А. Основы
токсикологии. Науч. метод. издание – СПб. – 2004. – С. 597-598.
2. Постановление
Правительства РФ от 29 декабря 2007 г. № 964 Об утверждении списков
сильнодействующих и ядовитых веществ для целей статьи 234 и других статей
уголовного кодекса Российской Федерации, а также крупного размера
сильнодействующих веществ для целей статьи 234 уголовного кодекса Российской
Федерации.
3.
Barroso M., Gallardo E.,
Margalho C., Ávila S., Marques E.P., Vieira D.N., López-Rivadulla
M. Application of solid phase microextraction to the determination of
strychnine in blood // Journal of Chromatography B. – 2005. – Vol. 816. –
Issues 1-2. – P. 29-34.
4.
Barroso M., Gallardo E.,
Margalho C., Marques E., Vieira, D.N., López-Rivadulla M. Determination
of Strychnine in Human Blood using Solid-Phase Extraction and GC—EI-MS //
Journal of Analytical Toxicology. –
2005. – Vol. 29. – №5. – P. 383-386.
5.
Dittrich K., Bayer M.J., A. L.
Wanke A case of fatal strychnine poisoning // Journal of Emergency Medicine. –
1984. – Vol. 1. – Issue 4. – P. 327-330.
6.
Duverneuil C., Grandmaison G.L.
, Mazancourt P., Alvarez J.-C. Liquid chromatography/photodiode array detection
for determination of strychnine in blood: a fatal case report // Forensic
Science International. – 2004. – Vol. 141. – Issue 1. – P. 17-21.
7.
Eenoo P., Deventer K., Roels K.,
Delbeke F.T. Quantitative LC–MS determination of strychnine in urine after
ingestion of a Strychnos nux-vomica preparation and its consequences in doping
control // Forensic Science International. – 2006. – Vol. 164. – Issues 2-3. –
P. 159-163.
8.
Marques E.P., Gil F., Proença
P., Monsanto P., Oliveira M. F., Castanheira A, Vieira D. N. Analytical method
for the determination of strychnine in tissues by gas chromatography/mass
spectrometry: two case reports // Forensic Science International. – 2000. –
Vol. 110. – Issue 2. – P. 145-152.
9.
Nishiyama T., Nagase M.
Strychnine poisoning: Natural course of a nonfatal case // The American Journal
of Emergency Medicine. – 1995. – Vol. 13. – N.2. – P. 172-173.
10. Philippe G., Angenot L.,
Tits M., Frédérich M. About the toxicity of some
Strychnos species and their alkaloids // Toxicon. – 2004. – Vol. 44. – N 4. –
P. 405-416.
11. Smith B.A. Strychnine
poisoning // Journal of Emergency
Medicine. – 1990. – Vol. 8. – Issue 3. – P. 321-325.
12. Toxicologycal Analysis. – Ed. Müeller R.K. –
Катаев Сергей Сергеевич
E-mail: forenschemist@narod.ru